 |
Главная |
Гальванические элементы
|
из
5.00
|
Если составить схему из двух металлических электродов, помещенных в растворы электролитов так, как показано на рис.3, и соединить электроды вне электролитов, то во внешней цепи возникнет электрический ток. Схема будет называться гальваническим элементом. В качестве примера рассмотрим медно- цинковый элемент.
Zn ⇆ Zn2+ + 2e, E0 = -0,76 B, (10)
Cu ⇆ Cu2+ + 2e, E0 = +0,34 B. (11)
|

Рис. 3. Схема медно-цинкового гальванического элемента (показан двойной электрический слой вокруг цинковой пластины)
Цинк более активен как восстановитель, он в ряду напряжений стоит значительно левее меди, поэтому он будет выделять в раствор большее количество катионов, чем медь. На цинковой пластине сосредоточится больший по абсолютной величине отрицательный заряд. Если затем соединить пластины проводником, то от цинковой к медной пластине по нему потечет поток электронов. Это нарушит равновесия (10) и (11). Химические реакции, протекающие на электродах, можно записать следующим образом:
на аноде:
 Zn – 2e = Zn2+ - процесс окисления,
Zn – 2e = Zn2+ - процесс окисления,
на катоде:
Å Cu2+ + 2e = Cu - процесс восстановления,
Суммарная реакция:
Zn(тв) +CuSO4(водн) = Cu(тв) +ZnSO4(водн).
Рассмотренный элемент – это биметаллический гальванический элемент (ГЭ) или ГЭ Даниэля-Якоби, или медно-цинковый ГЭ. Он может служить источником электрической энергии. При разомкнутой внешней цепи разность потенциалов его электродов называется электродвижущей силой гальванического элемента – ЭДС (Eэ). Стандартная ЭДС определяется как разность стандартных равновесных электродных потенциалов катода  и анода (
и анода ( 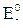 ):
):
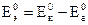 . (12)
. (12)
Если концентрации растворов катионов будут отличаться от стандартной величины 1моль/л, то вместо (12) следует пользоваться уравнением (13), которое учитывает (7):
 , (13)
, (13)
где n и m – заряды катионов металлов соответственно катода и анода.
Для описания гальванического элемента применяется условная запись:

 Zn ïZnSO4ïïCuSO4ïCu Å. (14)
Zn ïZnSO4ïïCuSO4ïCu Å. (14)
 первый второй
первый второй
полуэлемент полуэлемент
Гальванические элементы могут быть составлены из двух одинаковых полуэлементов, различающихся концентрацией катодного ск и анодного са растворов. Они называются концентрационными гальваническими элементами, например:
 Ag ïAgNO3ïïAgNO3ïAg Å, (16)
Ag ïAgNO3ïïAgNO3ïAg Å, (16)
ca cк
Выражение для ЭДС любого концентрационного гальванического элемента по (13) будет следующим:
 . (17)
. (17)
при условии ск>сa (при этом 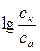 >0).
>0).
Электролиз – это несамопроизвольные процессы, в них химические реакции протекают при подведении к химическим системам электрической энергии. Это всегда окислительно-восстановительные реакции. Различают растворимые (активные) аноды из различных металлов кроме золота и платиновых металлов и нерастворимые (инертные) аноды из графита, золота и платиновых металлов.
На рис. 4 представлена схема электролиза раствора хлороводорода с платиновыми электродами. Анодное окисление и катодное восстановление составляют основу электролиза.
Процесс электролиза раствора HCl можно представить в виде следующих стадий:
1.Источник постоянного напряжения действует как насос электронов. Он откачивает их с анода и подводит их к катоду.
2.Противоположно заряженные по отношению к электродам ионы движутся к ним – анионы Cl- к аноду, катионы Н+ к катоду.
3.На катоде протекает реакция восстановления:
Н+ + е → Н,
на аноде протекает реакция окисления:
Cl- - e → Cl.
4.Образовавшиеся атомы водорода и хлора в свободном состоянии неустойчивы и соединяются попарно в молекулы:
Cl + Cl → Cl2↑, H + H → H2↑.
 2
2
 Анод (+) Катод (-)
Анод (+) Катод (-)
Pt 3 Рt 4 1
5
Рис. 4. Схема электролиза раствора HCl: 1– электролизер, 2– источник постоянного напряжения, 3 – анод (А), 4 – катод (К), 5 – раствор HCl
Если вместо раствора HCl взять раствор CuCl2, то на катоде будет осаждаться медь, а на аноде будет выделятся хлор:
на катоде: Cu2+ + 2e→ Cu,
на аноде: Cl- - e → Cl, Cl + Cl → Cl2.
Если изменить условия электролиза, взяв вместо инертных электродов медные, то вместо выделения на аноде хлора будет происходить растворение самого анода:
на аноде: Cu – 2е → Cu2+.
Потенциал этой реакции меньше потенциала окисления ионов хлора и поэтому она протекает в первую очередь. В результате на аноде медь будет переходить с электрода в раствор, а на катоде наоборот – выделятся из раствора. Общее же количество электролита в растворе не изменится. Таким способом в промышленности очищают черновую медь.
В некоторых случаях в качестве окислителя и восстановителя при электролизе водных растворов выступает вода, тогда протекают следующие реакции:
на катоде: 2H2O + 2e → H2↑ + 2OH-, (18)
на аноде: 2H2O – 4e → O2↑ + 4H+. (19)
Если электролит содержит по одному виду катионов и анионов, то при электролизе на соответствующем электроде будет разряжаться только один тип ионов. Например, при элетролизе расплава хлорида натрия будут протекать следующие процессы:
а) диссоциация NaCl → Na+ + Cl-;
б)  катод: Na+ Na+ +e → Na (ж);
катод: Na+ Na+ +e → Na (ж);
в) Å анод: Сl- Cl- - e → 0,5 Cl2 (г).
В случае электролиза растворов солей к катоду будут подходить катионы металлов и молекулы воды, в частности, гидратной воды. Для определения последовательности взаимодействия электронов катода с катионами и молекулами воды следует пользоваться рядом напряжений металлов, в который включена и вода, выступающая в роли окислителя. Для этого ряд напряжений схематически можно разделить на 3 зоны
pH = 14 pH = 7 pH = 0
: : :
E0,B -3 -0,83 -0,41 0,0 +3
 Зоны
Зоны 
I II III
Если по значению E0 металл попадает в зону III (E0>0), то на катоде восстанавливаются его катионы:
Men+ + ne → Me. (20)
В эту же зону попадают кислород и галогены, электродные потенциалы которых положительны (рис. 2,  ). Если металл имеет Е0 < - 0,83 B (зона I), то на катоде будет иметь место процесс восстановления молекул воды по (18). Если в растворе электролита будут находится катионы металла, который попадает в зону II, то на катоде могут протекать процессы восстановления как катионов по (20), так и молекул воды по (18). Если раствор содержит катионы нескольких металлов, то в первую очередь будут восстанавливаться катионы металла с наибольшим значением Е0.
). Если металл имеет Е0 < - 0,83 B (зона I), то на катоде будет иметь место процесс восстановления молекул воды по (18). Если в растворе электролита будут находится катионы металла, который попадает в зону II, то на катоде могут протекать процессы восстановления как катионов по (20), так и молекул воды по (18). Если раствор содержит катионы нескольких металлов, то в первую очередь будут восстанавливаться катионы металла с наибольшим значением Е0.
Анодные процессы. Так как на аноде протекают процессы окисления, то на нем в первую очередь должны окисляться наиболее сильные восстановители – т.е. вещества, имеющие наиболее отрицательный потенциал. Поэтому если анод растворимый ( 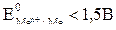 ), то происходит окисление металла анода так, как в случае электролиза раствора CuCl2 c медным анодом:
), то происходит окисление металла анода так, как в случае электролиза раствора CuCl2 c медным анодом:
Me – ne → Men+. (21)
При электролизе водных растворов электролитов с нерастворимым анодом в первую очередь окисляются (т.е. отдают электроны) анионы бескислородных кислот: J-, Br- и Cl-
Br- - e → Br. (22)
Если в растворе кислородсодержащие анионы: SO42-; PO3-; NO3-, то они не окисляются, а окисляется вода по (19), либо анионы ОН- по (23), если раствор щелочной:
4ОН- - 4е →О2 + 2Н2О. (23)
Законы Фарадея.
Первый закон: массы веществ, выделившихся или разложившихся при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит и их эквивалентным массам:
 , (24)
, (24)
где I – сила тока в амперах, А; τ – время в секундах, с; Мэ – эквивалентная масса в г/моль; F – число Фарадея, Кл/моль. Масса вещества, выделяющаяся при прохождении через электролит одного кулона электрического заряда, называется электрохимическим эквивалентом:
k =  / F (г/Кл). (25)
/ F (г/Кл). (25)
Учитывая (25), первый закон Фарадея можно представить следующими уравнениями:
 или m = q∙k, (26)
или m = q∙k, (26)
где q – электрический заряд или количество электричества в кулонах (А·с = Кл).
Второй закон Фарадея: при одинаковом количестве электричества, прошедшего через электролит, массы веществ, прореагировавших или образовавшихся на электродах, относятся друг к другу как молярные массы их эквивалентов:
m1/Mэ1 = m2/Mэ2 = … = mn/Mэn, (27)
где mi – массы веществ в граммах, Mэi – эквивалентные массы в г/моль.
Если электролизу подвергается раствор, содержащий катионы металла, значение Ео которого находится в пределах от –0,83 до 0 В (II зона катодных процессов), то на катоде протекают параллельные реакции. Часть количества электричества при этом расходуется на осаждение металла, а другая часть – на восстановление ионов водорода. Доля от общего количества электричества, которая расходуется на выделение одного из веществ, называется выходом по току данного вещества (ВТ). Выход по току металла рассчитывается по формуле:
BT(Me) = q(Me)/q, (28)
где q – общее количество электричества, Кл; q(Me) – количество электричества, затраченное на выделение металла, Кл.
Лекция №9.
|
из
5.00
|
Обсуждение в статье: Гальванические элементы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

