 |
Главная |
Электрохимия (продолжение).
|
из
5.00
|
План лекции:
1. Коррозия и её виды.
2. Методы защиты от коррозии.
Коррозией называется разрушение металлов вследствие химического или электрохимического воздействия на них окружающей среды. Способность металлов сопротивляться коррозионному воздействию агрессивных сред называется коррозионной стойкостью. Коррозионную стойкость оценивают по десятибальной шкале в мм/год (П) или в г/м2∙час (k), где П или k – скорость коррозии.
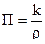 , (1)
, (1)
где ρ – плотность металла, г/см3.
Исходя из значений П или k, прогнозируют срок службы изделия, механизма или сооружения, учитывая внешние и внутренние факторы. Внутренние факторы включают химический состав металла, его структуру и напряженное состояние. Внешние факторы включают химический состав агрессивной среды, её температуру и давление.
Химическая коррозия не сопровождается возникновением электрического тока. К ней относятся:
I. Коррозия металлов в жидких неэлектролитах.
II. Газовая коррозия.
Органические жидкости, не проводящие электрического тока: бензин, спирт, нефть, смазочные масла, керосин и др. в чистом виде на металлы не действуют. Но в присутствии даже незначительных количеств примесей они становятся агрессивными.
2R-Cl + Me → MeCl2 + R-R, (2)
 R1
R1
 S + Me → MeS + R1-R2 (3)
S + Me → MeS + R1-R2 (3)
R2
Против указанной коррозии применяют два способа защиты: либо используют легированные стали, в частности, высокохромистые, либо покрывают детали машин и конструкций алюминием, стойким к средам, содержащим серу.
Газовая коррозия – это процесс разрушения металлов в результате их химического взаимодействия с газами при высокой температуре. Например, при плавке металлов, при горячей прокатке, при ковке, литье и обжиге. Агрессивными агентами могут быть Cl2; I2; О2; воздух, соединения серы. Продукты коррозии:
Me Cln ; Mem Sn; Mem On; Me Jn. (4)
Чаще всего имеет место образование оксидов:
Me + 0,5O2 → MeO. (5)
Скорость газовой коррозии зависит от природы металла и агрессивной среды, температуры и свойств продукта коррозии в виде пленки. Пленка обладает защитными свойствами, если она химически инертна к агрессивной среде, сплошная, непористая, имеет хорошее сцепление с металлом (адгезию) и их коэффициенты термического расширения близки. Так, пленка Al2O3 на алюминий защищает его от окисления.
Известны следующие способы защиты от газовой коррозии:
1. Использование легированных сталей. Стали содержащие 10-12% хрома, стойкие к газовой коррозии. При увеличении в них хрома до 18% и далее до 25-30% их коррозионная стойкость возрастает.
2. Применение защитных покрытий: из алюминия, хрома, кремния, жаростойких эмалей и иногда силоксановых полимеров.
3. Использование защитных газовых атмосфер. Когда термообработку ведут в инертных и восстановительных газовых средах: в неоне, в аргоне, в азоте. Для этой цели используются также водород, оксид углерода II, метан и этан.
Для протекания электрохимической коррозии необходим контакт металла с раствором электролита. Этот вид коррозии является преобладающим, т.к. в атмосферных условиях на поверхности металлов всегда образуется тонкий слой адсорбированной влаги.
Причины возникновения коррозионных гальванических элементов:
1. Если изделие выполнено из разных металлов.
2. Химическая неоднородность одного и того же металла.
3. Физическая неоднородность металла вследствие деформации от внешних нагрузок или теплового воздействия на его отдельные участки.
4. Местные нарушения лакокрасочных покрытий и различие в составах и концентрации электролитов, соприкасающихся с разными участками одного и того же металла.
На рис.1 показан пример коррозионного гальванического элемента – макропары.
е


Анод Fe Cu Катод
раствор электролита
Рис. 1. Короткозамкнутый коррозионный
гальванический элемент
Процесс коррозии будет состоять из следующих стадий:
Fe – 2e → Fe2+ . (6)
2H2О + O2 + 4e → 4OH- (процесс восстановления). (7)
Этот процесс называется кислородной деполяризацией. Ионы железа, оторвавшиеся от анода, и гидроксидные ионы катодной реакции, движущиеся по электролиту навстречу друг другу, образуют видимый продукт коррозии – гидрозакись железа в виде осадка.
Fe2+ + 2OH- → Fe(OH)2 ↓ . (8)
В дальнейшем гидрозакись взаимодействует с кислородом с образованием красной ржавчины – гидроокиси железа:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 ↓ . (9)
(ржавчина)
Если рН < 6,5 , то есть среда кислая, что имеет место в сточных водах крупных металлургических заводов, химических комбинатов и в емкостях для хранения и перевозки кислот, то в качестве окислителя будут выступать ионы водорода и катодный процесс будет следующим:
H+ + e → H , (10)
(реакция восстановления).
H + H → H2 ↑.
Этот процесс называется водородной деполяризацией.
Электрохимическая схема короткозамкнутого коррозионного гальванического элемента (рис. 1) будет выглядеть следующим образом:
 Fe | H2O, O2 | Cu Å ;
Fe | H2O, O2 | Cu Å ;  Fe | H+ | Cu Å . (12)
Fe | H+ | Cu Å . (12)
(в нейтральной среде) (в кислой среде)
Вторичные процессы и продукты электрохимической коррозии металлов.
Так, ионы таких металлов как Al, Fe, Mg, Ni образуют труднорастворимые гидроксиды:
Men+ + nOH- → Me(OH)n ↓. (13)
Железо в фосфорнокислых средах образует труднорастворимый фосфат железа:
3Fe2+ + 2PO43- → Fe3(PO4)2 ↓. (14)
Свинец в растворах H2SO4 и ее солей образует нерастворимый сульфат свинца:
Pb2+ + SO42- → PbSO4 ↓. (15)
Вторичные продукты коррозии железа, полученные по реакциям (8) и (9), претерпевают дальнейшие превращения с образованием сложных гидратированных оксидов – ржавчины:
FeO ∙ Fe2O3 ∙ mH2O. (16)
В случае коррозии алюминия, вторичный процесс ведет к образованию вначале гидроксида алюминия по (13):
Al3+ + 3OH- → Al(OH)3 ↓, (17)
который далее претерпевает следующее превращение с образованием защитной пленки:
2Al(OH)3 → 3H2O + Al2O3 ↓. (18)
Пленки вторичных труднорастворимых продуктов коррозии металлов придают металлам повышенную коррозионную стойкость, если затрудняют диффузионные процессы, увеличивая их роль в общем торможении всего процесса коррозии.
Методы защиты от коррозии.
1.Использование коррозионностойких металлов и сплавов является самым надежным средством в борьбе с коррозией и самым удобным, т.к. не требует дополнительных методов защиты металлов.
В технике и быту наиболее широко используются изделия из нержавеющих сталей. Нержавеющие стали содержат хрома от 13 до 30% - хромистые стали; хром-никелевые стали дополнительно к хрому содержат также 10 – 12% никеля. Одним из самых лучших металлов по коррозионной стойкости является титан. В атмосферных условиях скорость его коррозии не превышает 0,001 мм/год, а в морской воде его коррозионная стойкость еще выше.
2.Нанесение защитных покрытий. Защитные покрытия подразделяются на металлические и неметаллические. К неметаллическим органическим покрытиям относятся:
1. Лакокрасочные покрытия.
2. Полимерные покрытия. Из таких термопластов, как полиэтилен, полипропилен, полистирол, фторопласты и др..
3. Покрытия изделий резиной.
4. Покрытия смазками. Например, машинным маслом при недлительном хранении изделий на складе или при их транспортировке.
К неметаллическим неорганическим покрытиям относятся покрытия из оксидных пленок. Методы нанесения оксидных пленок: термические, химические и электрохимические.
а) Примером термического нанесения оксидной пленки может служить воронение сталей на воздухе при 300-500 ºС. После такой обработки стали становятся коррозионностойкими.
б) Химические способы включают обработку (пассивацию) металлов в растворах окислителей.
в) Электрохимические способы включают нанесение оксидных пленок на поверхности металлов в процессах электролиза.
Металлические покрытия разделяют на катодные и анодные. У катодных покрытий электродный потенциал выше, чем электродный потенциал защищаемого металла (например, покрытия из меди или никеля на углеродистой стали). Поэтому катодные покрытия защищают основной металл только механически, изолируя его от агрессивной среды. Если в них появится трещина, то в присутствии электролита основной металл будет анодом и будет разрушаться, а покрытие будет оставаться целым (до тех пор, пока имеется основной металл в качестве анода). У анодных покрытий электродный потенциал ниже, чем электродный потенциал защищаемого металла (например, Zn на углеродистой стали). Поэтому анодные покрытия защищают основной металл и механически и электрохимически. При нарушении покрытия в присутствии электролита оно выполняет роль анода и разрушается, а основной металл сохраняется невредимым до тех пор, пока все покрытие не разрушится.
 Например, слой цинка на оцинкованном железе является анодным покрытием и на рис.3 показана его схема до появления в нем трещины (а) и после образования трещины (б).
Например, слой цинка на оцинкованном железе является анодным покрытием и на рис.3 показана его схема до появления в нем трещины (а) и после образования трещины (б).

Zn

Zn
Fe Fe
 = -0,44В(катод)
= -0,44В(катод)
а) б)
Рис. 3. Схема металлического анодного покрытия
 Zn | H2O, O2 | Fe Å (нейтральная среда), (19)
Zn | H2O, O2 | Fe Å (нейтральная среда), (19)
 Zn – 2e → Zn2+ (окисление),
Zn – 2e → Zn2+ (окисление),
Å 2H2O + O2 + 4e → 4OH- (востановление).
 Zn | HCl | Fe Å (кислая среда), (20)
Zn | HCl | Fe Å (кислая среда), (20)
Zn – 2e → Zn2+ (окисление),
2H+ + 2e → H2 (востановление).
По (19) и (20) видно, что железо защищено электрохимически.
Примером катодного покрытия является олово на луженом железе (рис. 4).

 = -0,13B(катод)
= -0,13B(катод)
Sn
 Sn
Sn

Fe Fe
 = -0,44В(анод)
= -0,44В(анод)
а) б)
Рис. 4.Схема металлического катодного покрытия
 Fe | H2O, O2 | Sn Å (нейтральная среда), (21)
Fe | H2O, O2 | Sn Å (нейтральная среда), (21)
Fe - 2e → Fe2+ (окисление),
2H2O + O2 + 4e → 4OH- (востановление).
 Fe | HCl | Sn Å (кислая среда), (22)
Fe | HCl | Sn Å (кислая среда), (22)
Fe - 2e → Fe2+ (окисление),
2H+ + 2e → H2 (востановление).
Видно, что катодное покрытие не защищает основной металл от электрохимической коррозии.
Электрохимическая защита делится на два вида: протекторную и катодную. Протекторная защита заключается в том, что к защищаемой конструкции присоединяется электрод (болванка) из металла, имеющего в данной коррозионной среде более отрицательный потенциал, чем потенциал защищаемой конструкции. Присоединенный электрод называется протектором (протектор – лат. покровитель, защитник).

Рис.5. Пример протекторной защиты стального трубопровода
Разрушаться будет протектор, который надо периодически заменять.
Катодная защита заключается в том, что защищаемый металл присоединяют к отрицательному полюсу внешнего источника постоянного напряжения, а к положительному полюсу присоединяют дополнительный электрод – анод (из любого проводника).
Если в качестве электрода – анода использовать железную болванку, то во влажной почве процесс коррозии будет следующим:
Å анод Fe – 2e → Fe2+ (болванка), (23)
 катод 2H2O + 2e → H2 + 2OH- (трубопровод).
катод 2H2O + 2e → H2 + 2OH- (трубопровод).
Лекция №10.
Полимеры
План лекции:
1. Определение полимеров и их классификация.
2. Особенности строения полимеров. Гибкость цепи полимеров.
3. Области применения полимеров.
Полимерами называются вещества, молекулы которых состоят из большого числа атомных группировок, соединенных химическими связями в длинные цепи или большие трехмерные сетки. В зависимости от состава различают органические, неорганические и элементорганические полимеры. Простейшим органическим полимером является полиэтилен - продукт полимеризации этилена. Этилен (С2Н4) – ненасыщенный углеводород, газ. В его молекуле атомы углерода соединены между собой двойной связью:
Н Н
│ │
этен С = С или Н2С=СН2 . (1)
(этилен) │ │
Н Н
Две молекулы этилена могут соединиться, образовав молекулу бутилена:
бутен-1
СН2=СН2 + СН2=СН2 →СН3 -СН2 -СН=СН2 . (2)
мономер димер этилена(бутилен)
При соединении трех молекул образуется тример, четырех молекул – тетрамер и т.д.. Если соединится очень большое количество молекул - n, то образуется полимер (реакция полимеризации) :
nСН2=СН2  [- СН2 - СН2 -]n . (3)
[- СН2 - СН2 -]n . (3)
полимер
Многократно повторяющиеся группировки, которые являются остатками мономеров, называются звеньями или мономерными звеньями. Молекула, составленная из большого количества звеньев, называется макромолекулой или полимерной цепью. Число звеньев в цепи называется степенью полимеризации и обозначается буквой п. Следовательно, молярная масса полимера в n раз больше молярной массы мономерного звена:
Мпол = nМзв , n = от 1 до 10000 и более. (4)
Если Мпол @ до 1000, то полимер называется олигомером. Если Мпол от 104 до 106,то полимер называется высокополимером.
Макромолекулы могут быть построены из одинаковых по химическому составу мономеров, тогда полимер называют гомополимером. Если макромолекулы построены из различных мономерных звеньев, то полимер называется сополимером или смешанным полимером.
Кроме того полимеры могут быть линейного, разветвленного и сетчатого (пространственного) строения.
Гомоцепные полимеры имеют цепи из одинаковых атомов - углерода, серы, фосфора, кремния, а гетероцепные полимеры имеют цепи из различных атомов:
- С - С - С - С - С - , (7)
. . . - С - С - О - С - С - О - С - С - . . . .
|
Можно выделить следующие особенности строения полимеров.
1. Главная особенность строения полимеров - это наличие цепных молекул, содержащих большое число атомов, связанных между собой двумя типами связей (химическими и межмолекулярными), резко различающимися по энергии и длине. В самой цепи атомы связаны химическими связями, длина которых 1 - 1,5Å. Между цепями действуют значительно более слабые межмолекулярные силы на расстояниях порядка 3-4Å.
В сетчатых полимерах между цепями поперечные связи - химические.
2. Любой полимер полимолекулярен или полидисперсен. Поэтому молярная масса полимера Мпол – это средняя величина.
3. Полимеры могут быть полярными и неполярными, как и химические связи в их макромолекулах.
Условно полимеры можно подразделить на следующие классы:
- карбоцепные полимеры (цепи только из атомов углерода). К ним относятся полиэтилен (ПЭ); полипропилен (ПП); полистирол (ПС);полибутадиен (ПБД); полиизопрен (ПИ); поливинилхлорид (ПВХ); поливинилиденхлорид (ПВДХ); политетрафторэтилен (фторопласт) (ПТФЭ); полиметилметакрилат (ПММАК).
- Гетероцепные полимеры, например полиформальдегид.
- Неорганические полимеры. К ним относятся полисиланы, диоксид кремния (аморфный SiO2); поликремниевая кислота
Физические свойства полимеров определяются их химическим составом и строением. Взаимосвязь между строением и свойствами полимеров смогли понять только после открытия особого вида теплового движения – внутреннего вращения отдельных частей молекулы относительно друг друга вокруг одинарных химических связей. Оно получило название внутреннего вращения в молекуле.
За счет внутреннего вращения макромолекулы могут принимать разные конфигурации, которые называются конформациями или поворотными изомерами. Способность макромолекул полимеров к внутреннему вращению проявляется в таком их свойстве как гибкость или эластичность.
Полимерную цепь можно разбить на сегменты, положение которых в пространстве не зависит от положения соседних звеньев. А для того чтобы сегменты начали смещаться относительно друг друга макромолекуле необходимо сообщить энергию в виде теплоты, которая называется активационным или потенциальным барьером вращения.
Установлены следующие факторы, определяющие гибкость полимера:
1. Величина потенциального барьера вращения.
Она зависит от наличия в полимерных цепях полярных групп.
2. Размер заместителей.
3. Частота сшивки пространственной сетки.
4. Температура.
С повышением температуры кинетическая энергия макромолекул увеличивается. Пока kТ < Uo, звенья цепи полимера совершают только крутильные колебания, амплитуда которых тем больше, чем выше температура. При достижении Uo макромолекулы начинают изменять конформации, и полимер становится эластичным - гибким.
Полимеры имеют ряд особенностей:
1) Полимерные вещества имеют большую молярную массу (М) поэтому температуры кипения их должны быть очень высокими. Однако, при нагревании полимеры разлагаются, не достигнув температур кипения. Поэтому полимерные вещества не могут быть переведены в газообразное состояние, они могут находиться только в конденсированном состоянии: жидком или твердом.
2) Полимеры сетчатого строения, имеющие трехмерную сшитую структуру, являются неплавкими, нерастворимыми и неспособными к повторной переработке.Их называют реактопластами или термореактивными пластмассами. При нагревании только некоторые из них приобретают эластичные свойства (например, эпоксидные полимеры). Текучестью реактопласты не обладают.
3) В отличие от реактопластов линейные и разветвленные полимеры после формования изделий из них, а также после эксплуатации и износа этих изделий, способны к повторной переработке путем расплавления и формования новых изделий. Они называются термопластами. К термопластам относятся, например, полиэтилен, полипропилен, полистирол, поливинилхлорид.
Наиболее распространенными полимерами являются:
1) Полиэтилен
Полиэтилен является одним из самых дешевых полимеров, сочетающий свои ценные свойства со способностью перерабатываться всеми известными для термопластов способами. Поэтому в мировом производстве полимеров он занимает первое место. Из полиэтилена производят электроизоляцию проводов и кабелей, емкости для хранения агрессивных жидкостей, гальванические ванны и трубы, предметы домашнего обихода: ведра, тазы, ванны, корзинки, бутыли, ящики. Большое количество полиэтилена расходуется на изготовление пленки для сельского хозяйства (для парников) и упаковки продуктов питания и промышленных товаров.
2) Полипропилен
3) Поливинилхлорид
ПВХ является одним из наиболее распространенных полимеров. Из него получают около 3000 видов материалов и изделий, которые используются в электротехнической, легкой, пищевой, машиностроительной и строительной промышленности, а также в сельском хозяйстве. Например, из винипласта изготавливаются различные электротехнические изоляторы и детали. ПВХ пластифицированный идет на изоляцию проводов. Большое количество пластифицированного ПВХ расходуется на изготовление линолеума, который представляет собой ткань или нетканые волокна, или пергамент, пропитанные и покрытые ПВХ.
Недостатком ПВХ является то, что при нагревании выше 100 оС он заметно разлагается с выделением НСl, вследствие чего приобретает окраску от желтой до черной.
4) Полистирол
ПС и УПС используют для изготовления главным образом предметов бытовой техники: посуды, игрушек, авторучек, осветительной арматуры, мебели, панелей приборов, кассет, телефонных аппаратов и упаковочного материала в виде пенополистирола и пленки.
5) Фторопласт
Из фторопласта изготавливают детали и пленки в радиотехнической промышленности, детали и инструменты в медицине, посуду и детали в химических производствах и лабораториях.
Полимеры можно подразделить также на термопласты и реактопласты. Реактопласты являются трехмерными сшитыми полимерами. Поэтому они имеют более высокие, чем термопласты, показатели по твердости, прочности, модулю упругости, теплостойкости и усталостной прочности. У них также более низкий коэффициент термического расширения. Изделия из реактопластов получают в результате полимеризации (отверждения) смол (олигомеров) при помощи низкомолекулярных полифункциональных веществ – отвердителей. Жидкие смолы перемешивают с наполнителями и с отвердителями, затем формуют необходимые изделия, которые нагревают или облучают, что приводит к реакции сшивки, подобной вулканизации каучука. В отличие от термопластов, изделия из реактопластов не подвергаются повторной переработке.
Большое количество перечисленных смол идет в качестве связующих на изготовление полимерных композиционных материалов. Например, стеклопластики - это стеклоткани, пропитанные полиэфирной смолой, и в виде листов затем отвержденные под прессом. Гетинакс – это листы бумаги, пропитанные полиэфирной или феноло-формальдегидной смолой и в виде пластин отвержденные под прессом.
Некоторые композиционные полимерные материалы (КПМ) на основе реактопластов обладают очень высокими механическими свойствами. Например, из стеклопластиков изготавливают корпуса катеров, автомобилей и летательных аппаратов. А в производстве винтов для вертолетов с КПМ не может сравниться ни один из известных металлов и сплавов. Большое применение КПМ находят в радиотехнической промышленности, строительстве и машиностроении.
|
из
5.00
|
Обсуждение в статье: Электрохимия (продолжение). |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

