 |
Главная |
Механический принцип относительности 6 страница
|
из
5.00
|
Плотность вероятности является наблюдаемой на опыте физической величиной, в то время как сама волновая функция, будучи комплексной, недоступной наблюдению.
Волновая функция в квантовой механике – величина, полностью описывающая состояние микрообъекта (электрона, нуклона, атома, молекулы) и вообще любой квантовой системы.
Из смысла  – функции вытекает, что квантовая механика имеет статистический характер. С помощью
– функции вытекает, что квантовая механика имеет статистический характер. С помощью  – функции можно лишь предсказать, с какой вероятностью частица может быть обнаружена в различных точках пространства.
– функции можно лишь предсказать, с какой вероятностью частица может быть обнаружена в различных точках пространства.
На первый взгляд может показаться, что квантовая механика даёт значительно менее точное и исчерпывающее описание движение частицы, чем классическая механика. Однако это не так. Квантовая механика гораздо глубже вскрывает истинное поведение микрочастиц. Она лишь не определяет того, чего нет на самом деле. В применении к микрочастицам понятие определённого местоположения и траектории теряют смысл.
Так, если прибегнуть к модельным представлениям, то нужно представить электрон (и любую другую микрочастицу) «размазанным» по пространству в согласии с амплитудой  – функции. Когда же электрон взаимодействует с веществом (например, с серебром фотопластинки), он как бы «собирается» в точку и взаимодействует как целое. После взаимодействия электрон перестаёт описываться прежней
– функции. Когда же электрон взаимодействует с веществом (например, с серебром фотопластинки), он как бы «собирается» в точку и взаимодействует как целое. После взаимодействия электрон перестаёт описываться прежней  – функцией. Его распределение теперь оказывается очень узким и отлично от нуля только в области почернения фотопластинки.
– функцией. Его распределение теперь оказывается очень узким и отлично от нуля только в области почернения фотопластинки.
2).Уравнение Шредингера
Уравнение Шредингера – основное динамическое уравнение нерелятивистской квантовой механики; предложено австрийским физиком Э.Шредингером в 1926 г. Уравнение Шредингера описывает изменение во времени состояния квантовых объектов, характеризуемого волновой функцией. Если известна волновая функция  в начальный момент времени, то, решая уравнение Шредингера, можно найти
в начальный момент времени, то, решая уравнение Шредингера, можно найти  в любой последующий момент времени t.
в любой последующий момент времени t.
В квантовой механике это уравнение играет такую же фундаментальную роль, как уравнения Ньютона в классической механике и уравнения Максвелла в классической электродинамике. Уравнение Шредингера ниоткуда не выводится, а постулируется. Справедливость его доказывается тем, что выводы квантовой механики, полученные с помощью этого уравнения, находятся в согласии с опытом.
Э.Шредингер установил своё уравнение, исходя из оптико-механической аналогии. Эта аналогия заключается в сходстве уравнений, описывающих ход световых лучей, с уравнениями, определяющими траектории частицы в аналитической механике.
Математическим прообразом уравнения Шредингера послужило известное в математической физике волновое уравнение в форме Гельмгольца: ΔФ + k2Ф = 0, где Ф – некоторая скалярная функция; k = 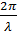 – волновое число; Δ =
– волновое число; Δ =  +
+  +
+  – оператор Лапласа. Уравнение Гельмгольца в двухмерном случае – уравнение мембраны, в одномерном случае – уравнение осциллятора.
– оператор Лапласа. Уравнение Гельмгольца в двухмерном случае – уравнение мембраны, в одномерном случае – уравнение осциллятора.
Временное уравнение Шредингера имеет вид:
iћ  =
= 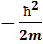 Δ
Δ 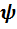 + U(
+ U( 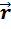 ,t)
,t) 
где U(  ,t) – потенциальная энергия частицы, движущейся в силовом поле; m – масса частицы; i =
,t) – потенциальная энергия частицы, движущейся в силовом поле; m – масса частицы; i =  - мнимая единица.
- мнимая единица.
В случае, когда функция U не зависит от времени (  = 0), то координатная часть волновой функции
= 0), то координатная часть волновой функции 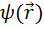 =
=  (x , y , z) удовлетворяет стационарному уравнению Шредингера:
(x , y , z) удовлетворяет стационарному уравнению Шредингера:
 ( W – U )
( W – U ) 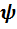 = 0,
= 0,
где W – энергия частицы.
Функции 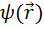 , удовлетворяющие стационарному уравнению Шредингера, называют собственными функциями. Они существуют лишь при определённых значениях энергии W, называемых собственными значениями энергии.
, удовлетворяющие стационарному уравнению Шредингера, называют собственными функциями. Они существуют лишь при определённых значениях энергии W, называемых собственными значениями энергии.
Совокупность собственных значений называется спектром величины.
Если эта совокупность образует дискретную последовательность, спектр называется дискретным. Если собственные значения образуют непрерывную последовательность, то спектр называется непрерывным (сплошным).
В случае дискретного спектра собственные значения энергии и собственные функции можно пронумеровать: W1, W2, … Wn; 
 …
… 
Таким образом, квантование энергии следует из основных положений квантовой механики. Применение этого уравнения к атому водорода дало результаты собственных значений энергии полностью совпадающих с экспериментальными данными и с результатами, полученными ранее из теории атома водорода Н.Бора. Однако, в общем случае нахождение собственных значений энергии и собственных функций – весьма трудная математическая задача.
Кроме того, решая уравнение Шредингера, мы получаем дискретный ряд значений энергии атома, соответствующих определённым боровским орбитам электронов, и находим значения волновой функции, указывающие на состояние атома в каждый момент времени.
Почти одновременно со Шредингером немецкий физик В.Гейзенберг построил такую формальную схему, вы которой вместо координат и скоростей электрона фигурировали некие абстрактные алгебраические величины – матрицы; связь матриц с наблюдаемыми величинами (уровнями энергии и интенсивностями квантовых переходов) давались простыми непротиворечивыми правилами. Работа В.Гейзенберга была развита Н.Бором и П.Иорданом[158]. Так возникла матричная механика. Вскоре после появления уравнения Шредингера была показана эквивалентность волновой (основанной на уравнении Шредингера) и матричной механики. Теперь мы говорим о квантовой механике, допускающей два математически эквивалентных способа изложения.
3). Соотношение неопределённостей Гейзенберга
Соотношение неопределённостей, предложенное В.Гейзенбергом в 1927 г. – следующий важный этап в развитии квантовой механики.
В классической физике не было принципиальных ограничений на точность измерений. Считалось, что при достаточно совершенной аппаратуре все величины, характеризующие физическую систему, могут быть измерены со сколь угодно высокой точностью. Но, как выяснилось, для микроскопических систем в ряде случаев существуют принципиальные ограничения на точность измерения физических величин. Эти ограничения не определяются совершенством измерительной техники. Каждое из них является фундаментальным свойством материи. Эти принципиальные ограничения на точность измерения физических величин количественно выражаются соотношениями неопределённостей.
В классической механике состояние материальной частицы определяется заданием координат, импульса, энергии и т.д. Перечисленные величины называются динамическими переменными. Однако информацию о микрочастицах мы получаем, наблюдая их взаимодействие с измерительными приборами, представляющими собой макроскопические тела. Поэтому результаты измерений мы вынуждены выражать в терминах, разработанных для характеристики макроскопических тел, т.е. через значения динамических переменных. В соответствии с этим измеренные значения динамических переменных приписываются микрочастицам. Например, говорят о состоянии электрона, в котором он имеет такое-то значение энергии и т.д.
Своеобразие свойств микрочастиц проявляется в том, что не для всех переменных получаются при измерениях определённые значения. Это и утверждают соотношения неопределённостей:
1) для координат и импульса
Невозможно одновременно точное измерение координат микрочастицы и собственных компонент её импульса:
Δ x ΔPx  ћ,
ћ,
Δ y ΔPy  ћ,
ћ,
Δ z ΔPz  ћ,
ћ,
где Δx, Δy, Δz – интервалы координат, в которых локализована микрочастица, если значения проекций её импульса заключены в пределах ΔPx, ΔPy, ΔPz (рис. 31).

Рис. 7.
2) для энергии и времени
Энергия микрочастицы в данном состоянии определяется тем точнее, чем она дольше находится в этом состоянии: Δ E  t
t  ћ,
ћ,
где ΔE – неопределённость энергии микрочастицы, которая находится в течение времени  t в состоянии с энергией Е.
t в состоянии с энергией Е.
Пример:
1. При Δx  0
0  ΔPx
ΔPx 
 , наоборот, при ΔPx
, наоборот, при ΔPx  0
0  Δx
Δx 
 .
.
Таким образом, чем более точно определено положение микрочастицы, тем менее точно её импульс и наоборот
2. При ΔE  0
0 
 t
t 
 , наоборот, при
, наоборот, при  t
t  0
0  ΔE
ΔE 
Таким образом, при взаимодействии микрообъекта с измерительным прибором энергию этого взаимодействия можно учесть лишь с точностью до  .
.
На основании соотношения неопределённостей удалось объяснить ряд фактов и явлений, которые не могла объяснить классическая физика:
· стабильность атома;
· существование и природу сил отталкивания между атомами и молекулами»
· недостижимость абсолютного нуля температур и наличие «нулевой» энергии у микрообъектов;
· естественную ширину спектральных линий.
Физический смысл соотношения неопределённостей нетривиален, в своё время был предметов споров между Н.Бором и А.Эйнштейном.
Иногда это соотношение интерпретировали так: в действительности у микрочастицы имеются точные значения координат и импульсов, однако ощутимое для такой частицы воздействие измерительного прибора не позволяет точно определить эти значения. Такое толкование неверно, т.к. противоречит наблюдаемым на опыте явлениям дифракции микрочастиц.
Соотношение неопределённостей указывает, в какой степени можно пользоваться понятиями классической физики применительно к микрочастицам.
В частности, применительно к микрочастицам теряет смысл понятие «траектория».
Соотношение неопределённостей – результат корпускулярно-волнового дуализма микрочастиц.
Пример : Оценим с точки зрения волн де Бройля и соотношения неопределённостей движение ружейной дроби и электрона в атоме.
1. Ружейная дробь (m = 10-3кг;  = 102 м/с):
= 102 м/с):
 =
=  =
=  = 6,63•10-33 м
= 6,63•10-33 м  ; Δx =
; Δx =  =
= 
 10-33м
10-33м  .
.
Вывод: т.к. длина волны де Бройля и неопределённость координаты такой макроскопической частицы как ружейная дробь чрезвычайно малы, то волновые свойства и соотношение неопределённостей для макрочастиц несущественны.
2. Электрон в атоме (m  10-30 кг;
10-30 кг; 
 106 м):
106 м):
 =
=  =
=  = 6,63•10-10 м
= 6,63•10-10 м  ra – длина волны де Бройля соизмерима с размерами атома.
ra – длина волны де Бройля соизмерима с размерами атома.
Δx =  =
= 
 10-10 м
10-10 м  ra – неопределённость координаты электрона в атоме также соизмерима с размерами атома.
ra – неопределённость координаты электрона в атоме также соизмерима с размерами атома.
Вывод: длина волны де Бройля и неопределённость координаты для электрона в атоме существенны.
Специфические квантовые свойства микрочастиц проявляются тем в большей степени, чем меньше их масса.
4). Орбиты электрона в атоме
Из теории атома Н.Бора, а также из решения стационарного уравнения Шредингера следует, что электрон в атоме может находиться только, разрешённых орбитах, определяемых условием: rn = r 1 n 2,
где r1 = 0,53•10-10м ‑ первый боровский радиус электрона[159]; rn - радиус n – ой орбиты электрона; n = 1, 2, 3, … ‑ главное квантовое число[160], определяет номер орбиты электрона и его энергию в атоме.
С точки зрения квантовой механики боровские орбиты электрона представляют собой геометрическое место точек, в которых с наибольшей вероятностью может быть обнаружен электрон (рис. 7).

Рис. 8.Радиальное распределение вероятности пребывания электрона для основного энергетического состояния атома водорода.
5). Квантование энергии, момента импульса и проекции момента импульса микрочастиц
В период создания квантовой механики одной из немногих известных в то время микрочастиц был электрон. Поэтому создатели квантовой механики занимались в основном изучением поведения электрона в атоме водорода и водородоподобных ионах[161]. Задача о движении в атоме двух электронов оказалась трудно разрешимой математической точки зрения. Впоследствии было установлено, что закономерности, полученные для электрона, справедливы и для других элементарных частиц.
Из теории атома Бора, а также из решения уравнения Шредингера следовало, что энергия электрона в атоме, его момент импульса и проекция момента импульса могут принимать дискретные, квантовые значения.
а). Правило квантования энергии
Собственные значения энергии электрона в водородоподобном атоме:
En =  Z 2
Z 2  •
•  =
=  Z 2 R •
Z 2 R •  ,
,
где знак минус  означает, что электрон находится в связанном состоянии; Z – порядковый номер элемента в периодической системе элементов; R =
означает, что электрон находится в связанном состоянии; Z – порядковый номер элемента в периодической системе элементов; R =  = 3,3 • 1015 с-1 – постоянная Ридберга[162]; n = 1, 2, 3, … - главное квантовое число.
= 3,3 • 1015 с-1 – постоянная Ридберга[162]; n = 1, 2, 3, … - главное квантовое число.
Энергетический уровень при n = 1, т.е. Е1 – наинизший энергетический уровень, называется основным; все остальные уровни (En > Е1) называются возбуждёнными.
б). Правило квантования момента импульса
Орбитальный момент ‑ момент количества движения частицы, обусловленный её движением в пространстве.
Момент импульса L микрочастицы обусловлен её движением в силовом поле, обладающем сферической симметрией, в частности, движением атомарного электрона в сферически – симметричном поле ядра по определённой замкнутой орбите (рис. 8).

Рис. 9.
(  e =
e = 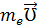 r – момент импульса электрона,
r – момент импульса электрона,  m – магнитный момент электрона)
m – магнитный момент электрона)
Согласно квантовой теории модуль вектора орбитального момента равен:
|  =
= 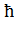
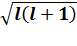 ,
,
где l = 0, 1,2, … (n  1) – орбитальное квантовое число, принимающее n – значений.
1) – орбитальное квантовое число, принимающее n – значений.
Таким образом, момент импульса электрона Lе, как и энергия, квантуется, т.е. принимает дискретные значения.
Для характеристики состояний с различными значениями орбитального числа l обычно используют спектроскопические названия орбитальных моментов в соответствии таблицей 1.
Таблица 1.
Спектроскопические названия орбитальных чисел l
| Значение l | Состояние |
| l = 0 | s-состояние |
| l = 1 | p-состояние |
| l = 2 | d-состояние |
| l = 3 | f-состояние |
| l = 4 | g-состояние |
| l = 5 | h-состояние |
| и т. д. | |
Состоянию с l = 0 отвечает сферически симметричная волновая функция. В тех случаях, когда l ≠ 0 волновая функция не имеет сферической симметрии.
в). Правило квантования проекции момента импульса
Орбитальный момент количества движения является векторной величиной. Так как величина орбитального момента количества движения квантуется, то и направление  е по отношению к какому-либо выделенному направлению z (например, к силовым линиям внешнего магнитного поля) также квантуется (это называют пространственным квантованием). Проекция на это направление принимает дискретные значения:
е по отношению к какому-либо выделенному направлению z (например, к силовым линиям внешнего магнитного поля) также квантуется (это называют пространственным квантованием). Проекция на это направление принимает дискретные значения:  = m l ћ,
= m l ћ,
где m l = 0,  1,
1,  2, …
2, …  l - магнитное квантовое число, принимает (2l + 1) значений.
l - магнитное квантовое число, принимает (2l + 1) значений.
Момент импульса электрона в атоме и его пространственные ориентации могут быть условно изображены векторной схемой, на которой длина вектора пропорциональна модулю орбитального момента импульса  е электрона. На рис. 9 приведены возможные ориентации вектора
е электрона. На рис. 9 приведены возможные ориентации вектора  е .
е .
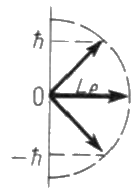

Р – состояние d - состояние
Рис. 10.
Вероятность обнаружения электрона в различных частях атома различна. Электрон при своём движении как бы «размазан» по всему объёму, образуя электронное облако, плотность которого характеризует вероятность нахождения электрона в различных точках объёма. Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число m l характеризует ориентацию электронного облака в пространстве (рис. 10).

Рис. 11.
г). Спин электрона
Для объяснения ряда закономерностей спектров щелочных металлов в 1925 г. С.Гаудсмит[163] и Д.Уленбек[164] выдвинули гипотезу, что электрон собственным моментом импульса, не связанным с движением электрона в пространстве. Этот собственный момент импульса был назван спином. Первоначально полагали, что спин обусловлен вращением электрона вокруг своей оси (т.е. электрон подобен волчку). Однако это противоречит теории относительности. Расчёты показывали, что при такой модели линейная скорость точек на поверхности вращающегося электрона должна в 200 раз превосходить скорость света в вакууме.
Наличие у электрона спина вытекает из полученного П.Дираком[165] релятивистского квантового уравнения для электрона.
Спин – это внутреннее квантовое число, присущее электрону подобно тому, как ему присущи заряд и масса – это квантовая и релятивистская величина. У спина нет классического аналога.
Абсолютная величина собственного момента импульса электрона (спина) квантуется согласно правилу: | 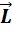 s | =
s | = 
 ,
,
где S =  ; 1 – спиновое квантовое число.
; 1 – спиновое квантовое число.
Пример 2:
1) Для электрона: S = 
 Les = ћ
Les = ћ  =
=  ћ.
ћ.
2) Для фотона: S = 1 
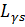 =
=  ћ.
ћ.
Проекция спина на заданное направление Z (например, на направление силовых линий внешнего магнитного поля) может принимать лишь квантованные значения: Lsz = ms ћ, где ms =  S – магнитное спиновое число.
S – магнитное спиновое число.
|
из
5.00
|
Обсуждение в статье: Механический принцип относительности 6 страница |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

