 |
Главная |
Влияние ингибиторов и активаторов на активность ферментов.
|
из
5.00
|
Активность ферментов может изменяться под влиянием различных внешних факторов.
Вещества, способные оказывать влияние на активность ферментов, обозначают как модуляторы ферментов. В свою очередь модуляторы подразделяют на две группы:
1. Активаторы. Под их влиянием происходит увеличение активности ферментов. В отличие от коферментов не принимают участие в реакции. В качестве активаторов могут выступать катионы металлов. Например, Na+ является активатором амилазы слюнных желез человека.
2. Ингибиторы. Вещества, под влиянием которых происходит уменьшение активности ферментов (например, CuSO4 является ингибитором у амилазы слюны). Ингибиторы представляют большую группу веществ, которые различаются по механизму ингибирующего действия.
По продолжительности ингибирующего эффекта ингибиторы подразделяются на:
- необратимые (которые при взаимодействии с ферментом навсегда лишают его ферментативной активности);
- обратимые (которые временно уменьшают активность фермента).
Механизм действия необратимых ингибиторов можно описать следующим уравнением:
In + E InE
где EIn – комплекс фермента с ингибитором, в котором он не обладает каталитическими свойствами.
Как правило, необратимые ингибиторы взаимодействуют с функциональными группами активного центра фермента. Они ковалентно соединяются с ними и, таким образом, блокируют их. В результате этого фермент утрачивает способность взаимодействовать с субстратом. Классическим примером необратимых ингибиторов являются фосфорорганические вещества. В исследованиях часто используется используется диизопропилфторфосфат (ДФФ). Фосфорорганические соединения соединяются с остатком серина в активном центре фермента:
К ферментам, которые содержат в активном центре серин, относятся холинэстераза, трипсин, эластаза и др.
В качестве других необратимых ингибиторов широкое применение находят алкилирующие агенты. Эти соединения взаимодействуют с SH-группами цистеина или имидазальными радикалами гистидина в активном центре. В качестве алкилирующих агентов как необратимых ингибиторов в биохимии находят применение иодацетамид, монойодацетат и др.
В отличие от ингибиторов необратимого действия обратимые ингибиторы лишь на определенный промежуток времени понижают активность ферментов. Механизм их ингибирующего эффекта можно представить в виде следующих уравнений реакций:
In + E EIn ; In + ES ESIn
Обратимые ингибиторы по механизму ингибирующего эффекта подразделяются на конкурентные и неконкурентные, которые отличаются друг от друга по механизму ингибирующего действия на фермент.
В случае неконкурентного ингибирования ингибитор обратимо присоединяется к ферменту не в его активном центре. В этом случае меняется конформация активного центра, что приводит к обратимой инактивации энзима. Под влиянием неконкурентного ингибиторане происходит изменения сродства фермента к его субстрату, но понижается максимальная скорость ферментативной реакции (Vmax). В качестве неконкурентных ингибиторов могут выступать промежуточные продукты обмена веществ.
Молекулы конкурентных ингибиторов имеют определенное сходство с истинным субстратом фермента. Классическим примером конкурентных ингибиторов является малоновая кислота, которая обратимо понижает активность фермента сукцинатдегидрогеназы. Под влиянием конкурентного ингибитора резко понижается сродство фермента к субстрату, но не изменяется Vmax. Явление конкурентного ингибирования может быть снято путем резкого повышения концентрации субстрата в реакционной смеси.
26.Специфичность действия ферментов. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра
Под субстратнойспецифич-ью подразумевается св-во ферментов катали-ать превращение одного или группы сходных по строению субст-ов.
Существует несколько видов субстратной специфичности ферментов.
1) Абсолютная специфичность. Под ней подразумевается способность фермента катализировать превращение только одного субстрата. Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало. К ферментам, обладающим абсолютной специфичностью, относятся аргиназа, уриказа рестриктазы и др.
2) Относительная специфичность. Под ней подразумевается способность фермента катализировать превращение группы сходных по строению субстратов . Бол-во ферментов катализирует однотипные реакции с небольшим кол-вом (группой) структурно похожих субстратов. При этом специфичность определяется тем, что фермент оказывает влияние только на опр-ый тип связи. Так, фермент панкреатическая липаза катализ-ет гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой мол-лы жира до молекулы моноацилглицерола и двух молекул высших жирных кислот. Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира. Боль-во протеоли-х ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфич-сть, гидролизуя пептидные связи, образованные разными аминок-тами.
3)Стереоспецифичность. Под этим термином подразумевается свойство фермента катализировать превращение одного стереоизомера субстрата. Так, ферменты, участвующие в превращении моносахаридов, проявляют специфичность по отношению к их D-стереоизомерам, а ферменты, участвующие в превращении аминокислот, – к их L-стереоизомерам.
Каталитическая специфичностьФермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и наз-ся каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов; фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако из-за особенностей строения каталит-х участков этих ферментов происходит разл-ое превращение этого соединения с обр-ем 4 разл-х продуктов.
27.Кинетика ферментативных реакций. Скорость ферментативных реакций зависит от концентрации субстрата. Эта зависимость носит сложный характер, который для определенных ферментов описывается параболической кривой.

Параболический характер зависимости объясняется тем, что при взаимодействии фермента с субстратом происходит образование фермент-субстратного комплекса. Первоначально при увеличении концентрации субстрата происходит возрастание концентрации фермент-субстратных комплексов в реакционной смеси, что проявляется в параллельном повышении скорости реакции. При определенной концентрации субстрата (насыщающей) возникает своеобразное “насышение” всех активных центров молекул ферментов в реакционной смеси. Скорость ферментативной реакции при насыщающей концентрации становится максимальной. При дальнейшем повышении содержания субстрата в реакционной смеси она не изменяется.
Из графика зависимости скорости ферментативной реакции от концентрации субстрата вычисляются два важных показателя:
1. Максимальная скорость реакции ( Vmax ). Она определяется как скорость реакции при насыщающей конце-ии субстрата. Величина максимальной скорости отражает каталитическую мощность фермента. Ферменты, обладающие большей величиной Vmax, являются более мощными катализаторами. В единицу времени они катализируют превращение большего количества молекул субстрата. Величина макс-ой скорости выражается числом оборотов фермента. Число оборотов оценивается количеством молекул субстрата, превращаемых ферментом в единицу времени (с-1). Для большинства ферментов число оборотов находится в пределах 104. В тоже время существуют ферменты, для которых число оборотов значительно больше (600000 – для карбангидразы) или меньше этой величины (100 – для химотрипсина).
2. Константа Михаэлиса (Км) - представляет собой концентрацию субстрата, при которой скорость реакции составляет половину максимальной. Величина Км отражает сродство фермента к субстрату. Чем больше эта величина, тем меньшее сродство к субстрату имеет фермент. Км выражается в молях субстрата. Так, величина Км по отношению к глюкозе у фермента глюкокиназы составляет 10 ммоль, а для гексокиназы – 0,01 ммоль. Гексокиназа проявляет большее сродство к глюкозе, чем глюкокиназа, при одинаковой концентрации субстрата она с большей скоростью катализирует фосфорилирование глюкозы.
На основании математического анализа кривой зав-ти скорости ферментативной реакции от конц-ии субстрата Л. Михаэлисом и М. Ментен (1913) была выведена формула, позволяющая оценить взаимоотно-ие между скоростью реакции, максим-ой скоростью и константой Михаэлиса. В настоящее время она опр-ся как уравнение Михаэлиса – Ментен.
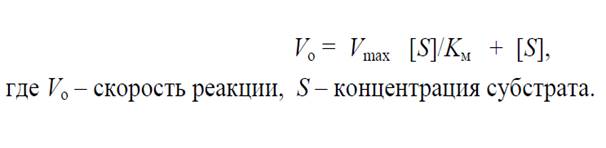
28 . Классификация и номенклатура ферментов. Классификация ферментов: В основу существующей классификации положен тип реакции, катализируемой ферментом. По этому признаку все ферменты подразделяются на шесть основных классов:
1) оксидоредуктазы – катализируют окислительно-восстановительные реакции;Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы (ЛДГ).
Различают следующие основные оксидоредуктазы:
а) аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород
б) анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород
в) цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода.
2) трансферазы – катализируют реакции переноса функциональных групп между молекулами субстратов; Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: метил- и формилтрансферазы, ацетилтрансферазы, аминотрансферазы, фосфотрансферазы и др. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза».
3) гидролазы – катализируют реакции гидролиза;
Катализируют расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза».
К ним относятся: а) эстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; б) гликозидазы, ускоряющие разрыв гликозидных связей;в) фосфатазы и пептидгидролазы, катали-щие гидролиз фосфоангидридных и пептидных связей; г) амидазы, ускоряющие разрыв амидных связей, отличных от пептидных
4) лиазы – катализируют реакции негидролитического распада молекул;
Катализируют разрыв связей С—О, С—С, С— N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др.
5) изомеразы – катализируют реакции внутри молекулярного переноса функциональных групп (изомеризации); Систематическое название их составляют с учетом типа реакции: «субстрат – цис-транс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза».
К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолеку-ые трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.
6) лигазы (синтетазы) – катализируют реакции присоединения путем образования новых связей (С–С С–О С–N).
Катализируют синтез орган-х в-в из двух исходных молекул с испол-ем энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X : Y лигаза», где X и Y обозначают исходные вещества. В качестве примера можно назвать L-глутамат: аммиак лигазу ,при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синт-ся глутамин.
Номенклатура ферментов: 1)Отдельные ферменты имеют тривиальные названия – трипсин, пепсин, цитохром с, и т.д. Эти названия сложились исторически и до сих пор широко используются.
2)Названия же больш-ва ферментов обр-ся путем прибавления суффикса ”аз” к названию субстрата, превращение которого катализ-ся ферментом. Напр: амилаза, глюкозо-6-фосфатаза, аргиназа..
3)Наибольшее распрост-ие получила международная номенклатура ферментов. Согласно ей названия ферментов складываются из названия субстратов и типа катализируемой реакции.
Например, фермент глюкокиназа катализирует реакцию фосфорилирования глюкозы согласно следующего уравнения:
АТФ + D – глюкоза Глюкозо-6-фосфат + АДФ
Системат-ое название этого фер-та–АТФ: D -глюкоза –6-фосфотрансфераза
29.Понятие метаболизма. Центральные и специальные метаболические пути В живых клетках протекает множество ферментативных реакций. Всю совокупность этих реакций объединяют общим понятием «метаболизм» («обмен веществ»).
Специфические функции: -снабжение химической энергией, которая добывается путем расщепления богатых энергией пищевых веществ, поступающих из среды, или путем преобра-ия улавливаемой энергии солнечного света; -превращение молекул пищевых веществ в строительные блоки, которые в дальнейшем используются клеткой для построения макромолекул; -сборка белков, нуклеиновых кислот, липидов, полисахаридов и прочих клеточных компонентов из этих строительных блоков; -синтез и разрушение тех биомолекул, которые необходимы для выполнения каких-либо специфических функций
Выделяют внешний и промежуточный обмен веществ:
-Внешний обмен веществ – внеклеточное переваривание веществ на путях их поступления и выделения из организма.
-Промежуточный обмен веществ превращение веществ внутри клеток с момента их поступления до обр-ия конечных продуктов.
Попав внутрь клетки, питательное вещество метаболизируется, т.е. претерпевает ряд хим-х изменений, катализируемых ферментами. Опр-ая последовательность таких химических изм-ий наз-ся метабол-им путём, а образующиеся промежуточные продукты – метаболитами. Большей частью метаболические пути линейны 

Кроме линейных выделяют циклические метаболические пути.
Обычно они имеют разветвления, в которых какие-нибудь продукты реакций выходят из цепи реакций данного метаболического пути или, наоборот, вливаются в нее
Все метаболические пути делят на центральные и специальные (вторичные).
Центральные метаболические пути – пути превращения основных пищевых веществ в клетке (углеводов, жиров, белков и нуклеиновых кислот).
На этих путях потоки метаболитов довольно внушительны. Например, в организме взрослого человека ежесуточно окисляется несколько сотен граммов глюкозы до СО2 и воды
Кроме центральных путей есть и другие метаболические пути со значительно меньшим потоком метаболитов (ежесуточный синтез или распад при этом измеряется миллиграммами).
Эти специальные метаболические пути составляют вторичный метаболизм, роль которого – в образовании различных специализированных веществ, требующихся клеткам в малых количествах.
К вторичным метаболическим путям принадлежит, например, биосинтез коферментов и гормонов, потому что эти соединения вырабатываются и используются только в следовых количествах. Сотни различных высокоспециализированных биомолекул, в том числе нуклеотиды, пигменты, токсины, антибиотики и алкалоиды, продуцируются у разных форм жизни на вторичных метаболических путях.
30.Катаболические, анаболические, амфиболические пути. Промежуточный метаболизм складывается из двух фаз: катаболизма и анаболизма. Катаболизм – это фаза, на которой происходит расщепление сложных орга-х молекул до более простых конечных продуктов. Углеводы, жиры и белки, поступившие извне с пищей или присутствующие в самой клетке в качестве запасных веществ, распадаются в серии последовательных реакций до таких соединений, как молочная кислота, СО2 и аммиак. Катаболические процессы сопровождаются высвобождением свободной энергии, заключенной в сложной структуре больших орг-х молекул. На определенных этапах соответствующих катаболи-х путей значительная часть свободной энергии запасается в форме высокоэнергет-го соединения – АТР . Часть ее запасается также в богатых энергией водородных атомах кофермента NАDН (NАDPН), находящегося в восстано-ой форме. Энергия в форме АТP и NАDPH используется на анаболических путях для биосинтеза макромолекул из небольших молекул -предшественников. Ферментативное расщепление тех главных пит-х в-в, которые служат клетке источником энергии, а именно углеводов, жиров и белков, совершается постепенно, т.е. через ряд последовательных ферментативных реакций. В аэробном катаболизме различают три главные стадии. На первой стадии макромол-лы клетки распадаются: полиса-ды до гексоз или пентоз, жиры до ж-х к-т, глицерола и др. комп-тов, белки – до ами-лот. На второй cтадии эти «строительные блоки» превращаются в один общий продукт ацетильную группу ацетил-СоА. На 3-ей стадии различные катаболи-ие пути сливаются в один общий путь – цикл лим-ой к-ты; в р-те всех этих превращений обр-ся только 3 конечных продукта. Расщепление нуклеиновых кислот происходит также поэтапно Все продукты, образовавшиеся на первой стадии катаболизма, на второй стадии превращаются в еще более простые соединения, число которых сравнительно невелико. Гексозы, пентозы и глицерол расщ-ются до одного и того же трехуглеродного промежуточного продукта (пируватa), а затем – до единственной двухуглеродной формы ацетильной группы ацетилкоферментa А (ацетил-СоА). Аналогичное превращение претерпевают жирные кислоты и углеродные скелеты большей части аминокислот: их расщепление также завершается обр-ем ацетильных групп в форме ацетил-СоА. Т. О.,ацетил-СоА пред-ет собой общий конечный продукт 2-ой стадии катаболизма. На третьей стадии ацетильная группа ацетил-СоА вступает в цикл лимонной кислоты – общий конечный путь, на котором почти все виды клеточного «топлива» в конце концов, окисляются до двуокиси углерода.
Конечными продуктами метаболизма являются также вода и аммиак (или другие азотсодержащие соединения). Катаболические пути сходятся, сливаясь на третьей стадии в общий путь – цикл лимонной кислоты. На первой стадии десятки и даже сотни различных белков расщепляются до аминокислот, которых насчитывается 20 видов, на 2-й стадии из всех 20 аминок-т обр-ся в основном только ацетил-СоА и аммиак, на третьей стадии ацетильные группы ацетил-СоА, окисляясь в цикле лимонной к-ты, превращаются только в 2 продукта – СО2 и Н2О. Анаболизм, называемый также биосинтезом, – та фаза метаболизма, в к-ой из малых молекул-предшественников, или «строительных блоков», синте-ся белки, нуклеиновые к-ты и другие макромолек-ые комп-ты клеток. Биосинтез – процесс, в результате которого увеличиваются размеры молекул и усложняется их структура, он требует затраты свободной энергии. Источником энергии служит распад АТP до АDP и неорганического фосфата. Для биосинтеза некоторых клеточных компонентов требуются также богатые энергией водородные атомы, донором которых является NADPH. Анаболизм, или биосинтез, начинающийся с малых молекул-предшественников, протекает также в три стадии. Синтез белков, например, начинается с образования α-кетокислот и других предшественников. На второй стадии происходит аминирование α-кетокислот в реакциях с донорами аминогрупп. Образуются α-аминокислоты. На последней, завершающей, стадии анаболизма из аминокислот строятся полипептидные цепи и образуются различные белки Сходным образом синтезируются липиды. Их синтез начинается с включения ацетильных групп в жирные кислоты и завершается сборкой различных липидных молекул из этих жирных кислот. В отличие от катаболизма для анаболизма характерно расхождение метаболи-х путей. Из сравнительно небольшого числа простых молекул-предшеств-в обр-ся в конечном счете весьма широкий набор разнообразных макромолекул. На центральных путях анаболизма имеется много ответвлений, что дает в результате сотни различных клеточных компонентов. Соответствующие катабол-ие и анабол-ие пути неидентичны, их связывает общая стадия (стадия III), к-я включает цикл лимонной кислоты и нек-ые вспомогательные фермента-ые реакции. Эту общую стадию называют иногда амфuболu-ой стадией метаболизма, поскольку она вып-ет двойную ф-ю. В катаболизме на этой стадии завершается распад сравнительно небольших молекул, образовавшихся на второй стадии, а в анаболизме ее роль заключается в поставке небольших молекул-предшест-в для биосинтеза аа, ЖК и углеводов.
31.Распад углеводов в желудочно-кишечном тракте. Роль амилол-их ферм-в. Углеводы пищи в пищеварительном тракте распадаются на мономеры под действием гликозидаз — ферментов амилазы, мальтазы, сахаразы, лактазы, катализирующих гидролиз гликозидных связей.
Моносахариды всасываются кишечной стенкой и затем попадают в кровь. В ротовой полости пища измельчается при пережёвывании, смачиваясь при этом слюной.
Слюна на 99% состоит из воды и обычно имеет значение рН, равное 6,8.
В слюне присутствует гидролитический фермент α-амилаза (α-l,4-гликозидаза), расщепляющая в крахмале α-l,4-гликозидные связи.
В ротовой полости крахмал не расщепляется полностью, т. к. действие фермента на него кратковременно. Кроме того, амилаза слюны не расщепляет α-l,6-гликозидные связи (связи в местах разветвлений); поэтому крахмал переваривается лишь частично с образованием крупных фрагментов (декстринов) и небольшого количества мальтозы.
Амилаза слюны не гидролизует гликозидные связи в дисахаридах.
Действие амилазы слюны прекращается в резко кислой среде содержимого желудка (рН 1,5 – 2,5). Однако внутри пищевого комка акт-ть амилазы может нек-ое время сохра-ся, пока уровень рН не изменится в кислую сторону.
В желудочном содержимом возможен лишь незначительный кислотный гидролиз гликозидных связей.
Последующие этапы переваривания нерасщеплённого или частично расщеплённого крахмала, а также других углеводов пищи происходит в тонком кишечнике, в разных его отделах, под действием гидролитических ферментов гликозидаз.
Моносахариды, поступившие в кровь, с ее током через воротную вену доставляются в печень. В клетках печени значительная часть глюкозы и других моносахаридов фосфорилируется.
Часть свободной глюкозы превращается в гликоген, который откладывается в гепатоцитах. Другая часть глюкозы направляется в большой круг кровообращения и разносится ко всем тканям организма.
|
из
5.00
|
Обсуждение в статье: Влияние ингибиторов и активаторов на активность ферментов. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

