 |
Главная |
Задания для самостоятельной работы
|
из
5.00
|
ВВЕДЕНИЕ
В процессе изучения предмета «Химия (I часть)» студенты должны четко усвоить химическую природу и свойства веществ, которые входят в состав продовольственных и непродовольственных товаров и формируют их потребительские свойства.
Методические указания к выполнению лабораторных работ по дисциплине «Химия (I часть)» проводится параллельно с чтением лекционного курса.
Данные методические указания подготовлены в соответствии с рабочей программой курса «Химия (I часть)» и предназначены для студентов направления подготовки 38.03.07. – «Товароведение» специализаций «Товароведение продовольственных (непродовольственных) товаров и коммерческая деятельность», профиля «Товароведение и экспертиза в таможенном деле».
ПОДГОТОВКА К РАБОТЕ
Целью проведения лабораторных работ является практическое изучение студентами химических методов исследования различных веществ, составляющих основу исследования сырья и материалов, приобретение практических навыков, которые могут быть использованы ими при изучении специальных дисциплин.
В процессе изучения этого курса студенты должны: уяснить, какая химическая природа и свойства веществ влияют на формирование качества товаров, какую роль играют отдельные вещества, входящие в состав товаров, ознакомиться с основными химическими методами исследования сырья и материалов.
В результате выполнения лабораторного практикума студент должен знать основные химические методы качественного и количественного анализа неорганических и органических соединений, составляющих основу сырья и материалов; уметь объяснять сущность методов исследования, проводить лабораторные определения, верно выполнять соответствующие расчеты и делать выводы.
Для выполнения лабораторных работ по той или иной теме в химической лаборатории студент должен подготовить теоретический материал по рекомендованной литературе и конспекту лекционного курса, а также оформить должным образом лабораторный журнал по рекомендованной в методических указаниях форме.
Все опыты студентам необходимо выполнять индивидуально, тщательно и аккуратно.
Каждому студенту необходимо иметь рабочий журнал (тетрадь для выполнения лабораторных работ), который должен быть оформлен по следующей форме (для лабораторных работ № 2-6, № 9-16):
1. Дата выполнения лабораторной работы.
2. Название лабораторной работы и ее номер.
3. Цель работы.
4. Таблица (на две страницы).
На левой странице
| Номер опыта | Название опыта | Выходные вещества, условия опыта | Наблюдения |
На правой странице
| Схемы реакций, которые протекают | Выводы |
5. Общий вывод о выполнении работы.
Для лабораторных работ № 1, 7а, 7б, 8 рабочий журнал (тетрадь для выполнения лабораторных работ) должен быть оформлен по следующей форме:
1. Дата выполнения лабораторной работы.
2. Название лабораторной работы и ее номер.
3. Цель работы.
4. Методика выполнения работы.
5. Расчеты.
6. Общий вывод о выполнении работы.
Каждый студент должен заносить в свой лабораторный журнал те данные, которые были им получены в процессе выполнения лабораторной работы. Работа считается выполненной после отчета студента перед преподавателем о ее выполнении и наличии подписи этой работы преподавателем.
Во время выполнения лабораторных работ студенты должны соблюдать основные правила техники безопасности.
ОСНОВНЫЕ ПРАВИЛА ПО ТЕХНИКЕ БЕЗОПАСНОСТИ
1. Студенты могут выполнять лабораторные работы только в присутствии преподавателя.
2. Ничего не пробовать на вкус, не принимать пищу в химических лабораториях.
3. Никаких веществ из аудитории кафедры естествознания и безопасности жизнедеятельности никому не давать и не позволять самовольно брать их домой.
4. Нюхать летучие вещества следует с осторожностью.
5. Не наклоняться над посудой, в которую что-нибудь наливают, чтобы избежать попадания брызг в глаза.
6. Не наклоняться над фарфоровой испарительной чашкой, в которой что-либо испаряется, во избежание ожога от возможных брызг.
7. Особенно важно беречь глаза, так как повреждения их даже малыми каплями вредных веществ может вызвать потерю зрения.
8. Пробирку с жидкостью, которая нагревается, держать отверстием в сторону от себя и от товарищей, так как жидкость вследствие перегрева иногда «выплескивается» из пробирки.
9. При нагревании растворов веществ в пробирках их следует заполнять не более чем на 1/3.
10. Твердые вещества нагревать только в сухих пробирках.
11. Нельзя нагревать пламенем или на электроплитке толстостенную стеклянную посуду (банки, стаканы), фарфорове ступки, цилиндры и другую измерительную посуду, а можно нагревать на электроплитке только ту посуду, которая имеет маркировку термостойкой.
12. Зажигать спиртовку только с помощью спички. Нельзя зажигать ее, поднося к другой горящей спиртовке, потому что пролитый спирт может вспыхнуть.
13. Тушить спиртовку только с помощью колпачка.
14. Не закрывать пробирку пальцем при взбалтывании жидкости, которая в ней находится. Взбалтывать следует, держа пробирку, стакан или колбу за верхнюю часть и слегка покачивая.
15. Наблюдая реакцию, держите пробирку в некотором отдалении от глаз.
16. Если химические реактивы, необходимые для проведения опыта, находятся в вытяжном шкафу, то и опыт нужно проводить под вытяжкой. При этом стекло вытяжного шкафа опускается таким образом, чтобы руки исследователя находились в шкафу, а лицо было защищено стеклом.
17. После мытья химической посуды ополаскивайте её дистиллированной водой.
18. Пользуясь тонкой химической посудой, нужно всегда помнить, что она очень хрупкая и может быть легко повреждена.
Термические ожоги могут быть получены при неосторожном обращении со спиртовками, электронагревательными приборами и т. п. при выполнении лабораторных работ. В случае термического ожога (от огня, пара, горячих предметов или электрической дуги) следует наложить мокрую антисептическую повязку из куска марли или бинта, смоченную раствором перманганата калия (w = 2-3 %), раствором питьевой соды (w = 2 % ), или раствором стрептоцида. Ни в коем случае нельзя смазывать место ожога вазелином или жирами. При серьезных ожогах (III и IV степень) до прихода врача рану покрывают лишь сухой стерильной повязкой.
Химические ожоги являются следствием неумелого обращения с концентрированными кислотами. Из концентрированных кислот наиболее сильные ожоги вызывает смесь нитратной (азотной) и хлоридной (соляной) кислот («царская водка»). Другие кислоты по вредности можно расположить в такой последовательности: нитратная (азотная), сульфатная (серная), фтороводородная (плавиковая), хлороводородная (соляная) и уксусная (этановая). При ожогах кислотами (азотной, серной, соляной, фосфорной) следует промыть место ожога большим количеством воды, а затем раствором питьевой соды (w = 3 %). Ожоги щелочами обмывают водой, затем нейтрализуют раствором уксусной или лимонной кислоты (w = 1-2 %). При ожоге фенолом обожженное место промывают водой с этиловым спиртом. В случае ожога бромом пораженное место смывают концентрированным раствором гипосульфита натрия или этиловым спиртом. При химическом ожоге глаз необходимо тщательно промыть глаза струей воды, а затем, в случае ожога щелочами, промыть раствором борной кислоты (w = 2 %), при ожоге кислотами – раствором питьевой соды (w = 3 %). Нельзя тереть глаза.
Порезы разбитым стеклянной посудой для остановки небольшой кровотечения могут быть обработаны раствором Н2О2 (w = 3 %).
1. СОДЕРЖАТЕЛЬНЫЙ МОДУЛЬ 1.
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ. РАСТВОРЫ
ЛАБОРАТОРНАЯ РАБОТА № 1
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА ПО ОБЪЕМУ ВОДОРОДА, КОТОРЫЙ ВЫДЕЛИЛСЯ
Цель работы: научиться на практике определять молярную массу эквивалента металла, используя при расчетах закон эквивалентов и газовые законы, научиться собирать простейшие химические установки.
Оборудование и реактивы:
- штатив;
- бюретка, 50,0-100,0 см3;
- двухколонная пробирка или изогнутая пробирка;
- открытая трубка;
- стеклянная воронка;
- резиновая трубка;
- пробки с просверленными отверстиями;
- 2н раствора серной кислоты;
- навеска металла.
Методика определения:
Соберите прибор, как показано на рис.1, и проверьте его на герметичность.

1 – бюретка на 50-100 см3;
2 – двухколонная пробирка или изогнутая пробирка;
3 – открытая трубка;
4 – резиновая трубка;
5 – пробки с просверленными отверстиями
Рис.1 – Схема лабораторной установки для определения молярной массы эквивалента металла.
Для этого сравнительную трубку (3) опустите на 10-15 см. Если система герметична, то уровень жидкости в мерной бюретке сначала немного уменьшится, а затем останется неизменным. Если система не герметична, при подъеме или опускании трубки поднимается (или опускается) уровень жидкости в бюретке (1). В этом случае необходимо более тщательно закрыть резиновые пробки, предварительно смочив их водой.
Убедившись в том, что прибор герметичен, в изогнутую пробирку (2) налейте 2-3 см3 2н раствора серной кислоты.
Кислоту наливайте таким образом, чтобы не намочить ту часть изогнутой пробирки, где будет находиться навеска металла. Переверните пробирку и положите в нее металл с известной массой, следя за тем, чтобы он не упал в кислоту.
Затем осторожно пристройте пробирку к прибору, как показано на рис.1. Тщательно уплотните пробки и проверьте снова герметичность установки как описано выше.
Сделайте замер начального уровня жидкости в мерной бюретке по нижнему менискому h1.
Термометром определите температуру в лаборатории (в 0С), барометром- атмосферное давление (в мм рт. ст.)
Собранный прибор на штативе слегка наклоните в сторону и легким постукиванием пальца по изогнутой пробирке (2) сбросьте металл в раствор кислоты. Необходимо при этом следить, чтобы прибор не утратил герметичность. Как только металл попадет в кислоту, начнется реакция с выделением водорода. Под давлением водорода уровень жидкости в мерной бюретке начнет опускаться, а в сравнительной трубке подниматься. После окончания химической реакции и охлаждения пробирки до комнатной температуры давление снова сравняется с атмосферным (вода в бюретке и в сравнительной трубке снова будет на одном уровне).
После этого сделайте замер нового уровня жидкости в бюретке h2. Разница уровней жидкости в измерительной бюретке после опыта и до начала опыта (Δh = h2- h1) и будет равняться объему водорода V (Н2), кторый выделяется при реакции. Из таблицы 1.1 найдите парциальное давление паров воды Н в зависимости от температуры t 0С.
Таблица 1.1 – парциальное давление паров воды Н в зависимости от температуры
| T 0C | H, мм рт. ст. | T 0C | H, мм рт. ст. | T 0C | H, мм рт. ст. |
| 14 | 11,9 | 20 | 17,5 | 26 | 25,2 |
| 15 | 12,8 | 21 | 18,6 | 27 | 26,7 |
| 16 | 13,6 | 22 | 19,8 | 28 | 27,3 |
| 17 | 14,5 | 23 | 21,1 | - | - |
| 18 | 15,5 | 24 | 22,4 | - | - |
| 19 | 16,5 | 25 | 23,8 | 100 | 760 |
Все полученные данные внесите в таблицу 1.2.
Таблица 1.2 – Результаты лабораторной работы
| h1, cм3 | h2, cм3 | Δh, cм3 | t, 0С | Pатм, мм рт.ст. | Н, мм рт. ст. | mМе, г |
Расчеты молярной массы эквивалента металла
Согласно закону эквивалентов, объем водорода, который выделяется при реакции, зависит от эквивалентной массы металла:
 (1.1)
(1.1)
где m(Mе) – навеска металла (г);
 – молярная масса эквивалента металла (г/моль);
– молярная масса эквивалента металла (г/моль);
V0 (н2) – объем водорода, измеренный при нормальных условиях, (см3);
 – объем одного эквивалента водорода при нормальных условиях,
– объем одного эквивалента водорода при нормальных условиях,
который равен 11200 см3.
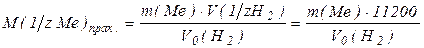 (1.2)
(1.2)
Навеска металла известна. Для того, чтобы определить объем водорода, выделяющегося при взаимодействии этого металла с кислотой при нормальных условиях V0 (Н2), воспользуемся известным газовым законом:
 (1.3)
(1.3)
где Р(н2); V(н2); Т – соответственно давление, объем и температура (по шкале
Кельвина) водорода в реальных условиях;
Р0 (н2); V0 (н2); Т0 – соответственно давление, объем и температура (по шкале
Кельвина) водорода в нормальных условиях;
Из формулы (1.3) найдем объем водорода при нормальных условиях:
 (1.4)
(1.4)
Замерять непосредственное давление водорода Р (Н2) не представляется возможным. Так как газ был собран над водой, то в бюретке находится смесь водорода и паров воды. Суммарное давление этой смеси состоит из парциальных давлений компонентов и уравновешивается атмосферным давлением, который мы и измерили.
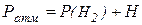 (1.5)
(1.5)
где Н – парциальное давление водяного пара в мм рт. ст., которое зависит от
температуры (табл. 1.1)
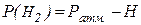 (1.6)
(1.6)
Подставив значения Р(н2), V(н2), Т0, Т и Р0(н2) в формулу (1.4), получим:
 (1.7)
(1.7)
И окончательно:
 (1.8)
(1.8)
Определите положение металла в периодической системе Д. И. Менделеева.
Поскольку 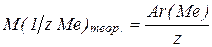 ,
,
где z – это валентность металла 1, або 2, або 3, то
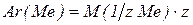
Определение ошибки эксперимента:
 (1.9)
(1.9)
Задания для самостоятельной работы
Изучить теоретический материал по теме, оформить лабораторный журнал, подготовиться к ответу на контрольные вопросы.
Контрольные вопросы:
1. Дайте определение понятию «химический эквивалент».
2. Почему атомная масса элемента – величина, в среднем, постоянная, а молярная масса эквивалента – переменная?
3. Сформулируйте закон эквивалентов.
4. Какой объем при нормальных условиях занимает один моль эквивалента водорода? Кислорода?
5. При восстановлении водородом 10,17 г оксида двухвалентного металла образовалось 2,25 г воды, молярная масса эквивалента которой 9,00 г/моль. Вычислите молярную массу эквивалента оксида и молярную массу эквивалента металла. Чему равна атомная масса металла?
6. Оксид трехвалентного металла содержит 31,58 % кислорода. Вычислите молярную массу эквивалента оксида и атомную массу этого элемента.
7. Вычислите молярную массу эквивалента Н3РО4 в реакциях образования:
а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
8. 2,48 г оксида одновалентного металла содержит 1,84 г металла. Вычислите молярную массу эквивалента металла и его оксида.
9. При взаимодействии 3,24 г трьохвалентногого металла с кислотой выделилось 4,03 л водорода, измеренного при нормальных условиях. Вычислите молярную массу эквивалента и атомную массу металла.
ЛАБОРАТОРНАЯ РАБОТА № 2
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Цель работы: изучение свойств растворов электролитов, электропроводности, химической активности сильных и слабых электролитов, определение факторов, влияющих на степень диссоциации электролита, приобретение навыков выполнения экспериментальных исследований.
Оборудование и реактивы:
- прибор для определения электропроводности;
- штатив с пробирками;
- раствор сахара;
- раствор спирта;
- раствор хлорида натрия;
- 2 н раствор соляной кислоты;
- 2н раствор гидроксида натрия;
- соляная кислота (конц.);
- бензол;
- уксусная кислота (конц.);
- 25 % раствор аммиака;
- 2н раствор уксусной кислоты;
- 2 н раствор гидроксида аммония;
- индикатор – метиловый оранжевый;
- индикатор – спиртовой раствор фенолфталеина;
- хлорид кальция;
- кусочек цинка;
- ацетат натрия;
- 0,005 М раствор нитрата свинца;
- 0,05 М раствор йодида калия;
- 0,05 М раствор хлорида калия;
- дистиллированная вода.
|
из
5.00
|
Обсуждение в статье: Задания для самостоятельной работы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

