 |
Главная |
Необходимые исходные сведения и основные уравнения
|
из
5.00
|
Для мономолекулярных обратимых реакций типа А « В дифференциальные формы кинетического уравнения:
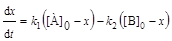 ,(6.1)
,(6.1)
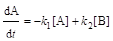 .(6.2)
.(6.2)
При равновесии 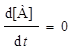 , и если при t = 0 [B] = 0, то
, и если при t = 0 [B] = 0, то
[В]р/[А]р 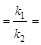 Кр; (6.3)
Кр; (6.3)
[B]р = [А]0 - [А]р;(6.4)
[В]р 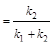 [А]0,(6.5)
[А]0,(6.5)
где [А], [B] – текущие концентрации веществ А и В; [А]0 – концентрация А при t = 0; k1 и k2 – константы скорости прямой и обратной реакций; [А]р и [B]р – концентрации А и В при равновесии; Кр– константа равновесия.
Интегральные формы кинетического уравнения:
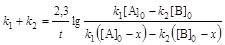 ;(6.6)
;(6.6)
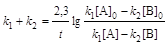 . (6.6а)
. (6.6а)
При условии, что в момент времени t = 0 [B]0 = 0:
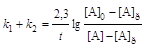 .(6.7)
.(6.7)
Для мономолекулярных параллельных реакций типа
С А ® В дифференциальные формы кинетического уравнения:
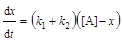 ;(6.8)
;(6.8)
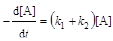 .(6.9)
.(6.9)
Интегральные формы кинетического уравнения:
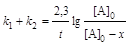 ; (6.10)
; (6.10)
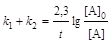 , (6.11)
, (6.11)
где k1 и k2 – константы скорости первой и второй реакций. Константы скоростей отдельных стадий для реакций данного типа определяют по соотношению:
х1/х2 = k1/k2, (6.12)
где х1 и х2 – количества молей веществ В и С, образовавшихся к моменту времени t или приращение концентраций веществ В и С. Текущая концентрация исходного вещества имеет вид
[А] = [А]0 – х. (6.12а)
Для мономолекулярных последовательных реакций типа
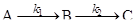 дифференциальные формы кинетического уравнения:
дифференциальные формы кинетического уравнения:
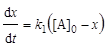 ; (6.13)
; (6.13)
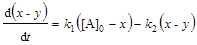 ; (6.14)
; (6.14)
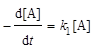 ; (6.15)
; (6.15)
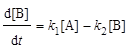 ; (6.16)
; (6.16)
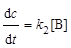 . (6.17)
. (6.17)
Интегральные формы кинетического уравнения:
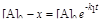 ; (6.18)
; (6.18)
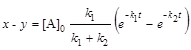 ; (6.19)
; (6.19)
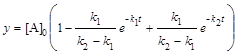 ; (6.20)
; (6.20)
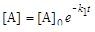 ; (6.21)
; (6.21)
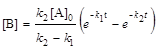 ; (6.22)
; (6.22)
[C] = [А]0 - [А] - [B], (6.23)
где [А], [В], [С] – текущие концентрации веществ А, В, С; [А]0 – концентрация вещества А при t = 0; k1 и k2 – константы скорости первой и второй реакций: [А] = [А]0 – х; [В] = x – y; [C] = y .
Точка максимума на кривой [В] = f(t) характеризуется уравнениями
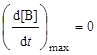 ; (6.24)
; (6.24)
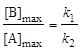 ; (6.25)
; (6.25)
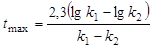 , (6.26)
, (6.26)
где tmax – время соответствующее максимальной концентрации вещества В.
Задачи с решениями
1. Для обратимой реакции первого порядка 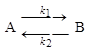
Кр = 8, а k1 = 0,4 c-1. Вычислите время, при котором концентрации веществ А и В станут равными, если начальная концентрация вещества В равна 0.
Решение. Из константы равновесия находим константу скорости обратной реакции: k-1 = k1/К= 0,4/8 = 0,05 с-1. По условию мы должны найти время, за которое прореагирует ровно половина вещества А. Для этого надо подставить значение х(t) = а/2 в решение кинетического уравнения для обратимых реакций:
t 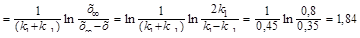 .
.
Ответ: t = 1,84 с.
2.В параллельных реакциях первого порядка С А ® В выход вещества В равен 63%, а время превращения а на 1/3 равно 7 мин. Найдите k1 и k2.
Решение.Кинетическое уравнение для разложения вещества в параллельных реакциях имеет вид уравнения первого порядка 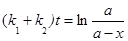 , в которое вместо одной константы входит сумма констант скорости отдельных стадий. Следовательно, по аналогии с реакциями первого порядка, по времени превращения А на 1/3 (х(t) = a /3) можно определить сумму констант k1+ k2:
, в которое вместо одной константы входит сумма констант скорости отдельных стадий. Следовательно, по аналогии с реакциями первого порядка, по времени превращения А на 1/3 (х(t) = a /3) можно определить сумму констант k1+ k2:
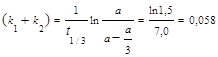 мин-1.
мин-1.
Выход вещества В равен 63%, а вещества D – 37%. Отношение этих выходов равно отношению конечных концентраций веществ В и D, следовательно оно равно отношению соответствующих констант скоростей
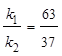 . Решая это уравнение совместно с предыдущим, находим: k1 = 0,037, k2 = 0,021.
. Решая это уравнение совместно с предыдущим, находим: k1 = 0,037, k2 = 0,021.
Ответ: k1 = 0,037 мин-1, k2 = 0,021 мин-1.
3.В системе протекают две параллельные реакции А + 2В→ → продукты (k1) и A +2C → продукты (k 2). Отношение k1/ k2 = 5. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировала к этому моменту?
Решение. Запишем кинетические уравнения для первой и второй реакций: 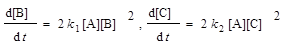 . Поделив одно кинетическое уравнение на другое, избавимся от временной зависимости и получим дифференциальное уравнение, описывающее фазовый портрет системы, т. е. зависимость концентрации одного из веществ от концентрации другого:
. Поделив одно кинетическое уравнение на другое, избавимся от временной зависимости и получим дифференциальное уравнение, описывающее фазовый портрет системы, т. е. зависимость концентрации одного из веществ от концентрации другого: 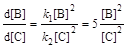 с начальным условием [В]0 = [С]0. Это уравнение решается методом разделения переменных:
с начальным условием [В]0 = [С]0. Это уравнение решается методом разделения переменных: 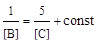 , где константа находится из начального условия
, где константа находится из начального условия 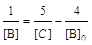 . Подставляя в это решение [В] = [В]0/2, находим [С] = 5[В]/6 = 5[С]0/6, т.е. к моменту времени t прореагирует 1/6 вещества С.
. Подставляя в это решение [В] = [В]0/2, находим [С] = 5[В]/6 = 5[С]0/6, т.е. к моменту времени t прореагирует 1/6 вещества С.
4.Реакция разложения изопропилового спирта протекает в присутствии катализатора триоксида ванадия при 588 К с образованием ацетона, пропилена и пропана. Концентрации веществ реакции, измеренные через 4,3 с после начала опыта, следующие, ммоль: с 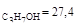 ; с
; с 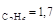 ; с
; с 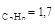 . Определите константу скорости каждой реакции, если в начальный момент в системе присутствовал только С3Н7ОН.
. Определите константу скорости каждой реакции, если в начальный момент в системе присутствовал только С3Н7ОН.
Решение: Определим начальное количество С3Н7ОН: [А]0 = с1 + с2 + с3 + с4 = 24,7 + 7,5 + 8,1 + 1,7 = 44,7 ммоль/л. Вычислим сумму констант скоростей реакций:
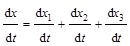
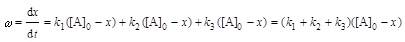
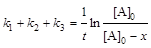 ,
, 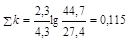 c-1.
c-1.
Определим константу скорости каждой реакции:
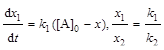 ;
; 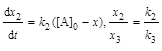 ;
; 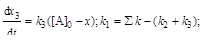
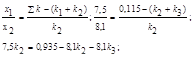
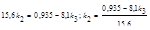 ;
;
Так как х2/х3 = k2/k3, то 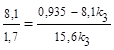 ;
;
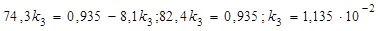 ;
;
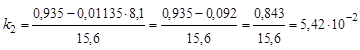 с-1;
с-1;
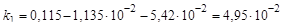 .
.
Ответ: 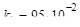 с-1.
с-1.
5. Последовательная реакция первого порядка протекает по схеме 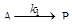
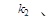 В. При 298 К имеет удельные скорости: k1 = 0,1 ч-1; k2 = 0,05 ч-1; начальная концентрация исходного вещества [А]0 = 1 моль/л. Вычислите: 1) координаты максимума кривой [Р] = f ( t ); 2) время достижения концентрации [А] = 0,001 моль/л, продолжительность tA реакции А→Р; 3) концентрации [Р] и [В] в момент окончания реакции А→Р; 4) время, за которое концентрация В достигнет значении 0,01 моль/л и продолжительность индукционного периода этой реакции, tинд; 5) координаты точки перегиба кривой [В] = f ( t ); 6) точку пересечения кривых [А] = f ( t ) и [Р] = f ( t ). Решение: Рассчитаем время, которому будет соответствовать максимальная концентрация промежуточного продукта, ч:
В. При 298 К имеет удельные скорости: k1 = 0,1 ч-1; k2 = 0,05 ч-1; начальная концентрация исходного вещества [А]0 = 1 моль/л. Вычислите: 1) координаты максимума кривой [Р] = f ( t ); 2) время достижения концентрации [А] = 0,001 моль/л, продолжительность tA реакции А→Р; 3) концентрации [Р] и [В] в момент окончания реакции А→Р; 4) время, за которое концентрация В достигнет значении 0,01 моль/л и продолжительность индукционного периода этой реакции, tинд; 5) координаты точки перегиба кривой [В] = f ( t ); 6) точку пересечения кривых [А] = f ( t ) и [Р] = f ( t ). Решение: Рассчитаем время, которому будет соответствовать максимальная концентрация промежуточного продукта, ч:
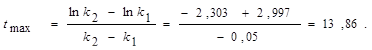
Обозначим концентрацию А при tmax через [А]max. Тогда [А]max = [А] 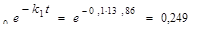 моль/л; максимальная концентрация промежуточного продукта будет [Р]max = (k1/k 2 ).[А]max = (0,1/0,05).0,249=0,598 моль/л. Примем [А]0 = = 0,001 моль/л; тогда
моль/л; максимальная концентрация промежуточного продукта будет [Р]max = (k1/k 2 ).[А]max = (0,1/0,05).0,249=0,598 моль/л. Примем [А]0 = = 0,001 моль/л; тогда 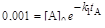 ;
; 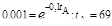 ч. Рассчитаем концентрацию Р при t = 69 ч:
ч. Рассчитаем концентрацию Р при t = 69 ч:
[В] 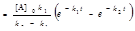 ;
; 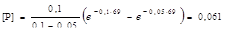 моль/л.
моль/л.
Рассчитаем концентрацию продукта [В] через 69 ч: [В] = = [А]0 - [Р] - [А] = = 1 – 0,061 – 0,001 = 0,938 моль/л. Вычислим время tинд, за которое устанавливается концентрация В, равная 0,01 моль/л, по уравнению
[В] = [А]0 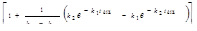 ; [В]
; [В] 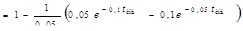 ;
; 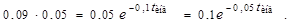 (1)
(1)
Уравнение (1) решаем относительно tинд методом подбора на основании экспериментальных данных:
| tинд, ч | 1 | 2 | 2,5 | 3 | 4 |
| [В], моль/л | 0 | 0,008 | 0,014 | 0,018 | 0,032 |
Принимаем tинд = 2 ч. Точку перегиба кривой [В] = f ( t ) находим, используя условие 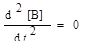 . После дифференцирования и преобразований уравнения [В]=[А]0•
. После дифференцирования и преобразований уравнения [В]=[А]0• 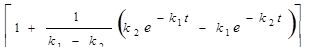 полу-чим точку перегиба:
полу-чим точку перегиба: 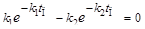 или
или 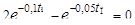 , где tП – координата точки перегиба, которую находим методом подбора для значений индукционных периодов tинд 5, 15, 10, 20 ч. Строим график зависимости х = f ( t ): х = 2е-0,1t – е-0,05t, откуда х = 0,05 при t = 13,6 ч. Концентрацию [В] в точке перегиба находим по уравнению (2): [В] = = 0,243 моль/л.
, где tП – координата точки перегиба, которую находим методом подбора для значений индукционных периодов tинд 5, 15, 10, 20 ч. Строим график зависимости х = f ( t ): х = 2е-0,1t – е-0,05t, откуда х = 0,05 при t = 13,6 ч. Концентрацию [В] в точке перегиба находим по уравнению (2): [В] = = 0,243 моль/л.
|
из
5.00
|
Обсуждение в статье: Необходимые исходные сведения и основные уравнения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

