 |
Главная |
Необходимые исходные сведения и основные уравнения
|
из
5.00
|
ЭДС гальванического элемента Е равна разности условных электродных потенциалов его полуэлементов φ1 и φ2. Если значением диффузионного потенциала можно пренебречь то
Е = φ2 - φ1(2.1)
(индекс 2 относится к более положительному электродному потенциалу). Электрохимические реакции, протекающие на электродах, и сами электроды разделяют на следующие типы:
1. Электроды 1-го рода, обратимые по катиону: Меn + + ne = =Ме0, где Меn + и Ме0 ― окисленная и восстановленная формы вещества; n е - количество электронов. Потенциал электрода 1-го рода рассчитывается по уравнению Нернста:
φ = φ0  (aOx/ aRed),(2.2)
(aOx/ aRed),(2.2)
где φ - потенциал электрода, В; φ0 - стандартный потенциал электрода, В; n - число электронов, участвующих в элемен-тарной реакции; F - число Фарадея; aRed и aOx - активности вос-становленной и окисленной форм вещества, вступающего в реакцию. Множитель  при Т = 298 К и значении R , равном 8,31 Дж/(моль.К), равен 0,059. К электродам 1-го рода относятся:
при Т = 298 К и значении R , равном 8,31 Дж/(моль.К), равен 0,059. К электродам 1-го рода относятся:
а) серебряный электрод:
Ag+│Ag; Ag+ + e = Ag0; n =1;aOx = aAg+; aRed = aAg =1,
φ = φ0Ag+  lgaAg+; (2.3)
lgaAg+; (2.3)
б) амальгамный электрод:
Cd2+ │[Cd] (Hg)Cd2+ + 2e = [Cd]ам; n = 2; aOx = aCd+
 ; φ = φ0AСd2+
; φ = φ0AСd2+  ,(2.4)
,(2.4)
где φ  - потенциал амальгамного электрода при активности кадмия в амальгаме, а[Cd] = 1;
- потенциал амальгамного электрода при активности кадмия в амальгаме, а[Cd] = 1;
в) газовый электрод:
H+ │Pt, H2; H+ + e =½ H2; n = 1; aOx = aH++; aRed =  =
= 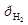 ;
;
φ = φ 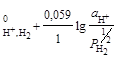 .(2.5)
.(2.5)
2. Электроды 2-го рода, обратимые по аниону, представляют собой металл, покрытый труднорастворимой солью этого метал-ла, который находится в равновесии с раствором, содержащим соответствующий анион: AgCl + e = Ag + Cl-; n=1; aOx = aAgCl = 1; aRed = aCl-;
φ = φ  ; (2.6)
; (2.6)
φ02 = φ  ,(2.7)
,(2.7)
где j 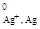 ― стандартный потенциал серебряного электрода, обратимого по катиону; ПРAgCl ― произведение растворимости хлорида серебра. К электродам 2-го рода относятся:
― стандартный потенциал серебряного электрода, обратимого по катиону; ПРAgCl ― произведение растворимости хлорида серебра. К электродам 2-го рода относятся:
а) газовый электрод:
½ Cl2 + e = Cl-; n = 1; aOx =  ; aRed =
; aRed =  ;
;
φ = φ  . (2.8)
. (2.8)
б) каломельный электрод Cl-│Hg2Cl2, на котором идет электродная реакция HgCl2 + 2e = Hg+ + 2Cl- ;
φ 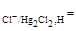 φ
φ 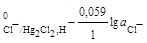 .
.
в) хлорсеребряный электрод Cl-│AgCl, Ag, на котором идет электродная реакция AgCl + e = Ag+ + Cl-;
φ 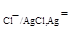 φ
φ 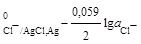 .
.
Окислительно-восстановительные электроды (редокси – электроды) представляют собой инертный металл, опущенный в раствор, содержащий окисленную и восстановленную формы. Уравнение Нернста для данных электродов имеет вид:
φ Red = φ  , (2.9)
, (2.9)
где аОх(аО) ― активность окисленного иона; aRed(aВ) - активность восстановленного иона. Они делятся:
а) на простые: Fe3+ + e = Fe2+; n = 1; aRed =  ; aOx =
; aOx = 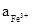 ;
;
φ = φ  ; (2.10)
; (2.10)
 ; n = 1;
; n = 1; 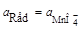 ;
;  ;
;
φ = φ  ;(2.11)
;(2.11)
б) на сложные:
 ;
;
φ = φ  . (2.12)
. (2.12)
Хингидронный электрод: C6H4O2 (хинон) + 2H+ + 2e = = C6H4(OH)2 (гидрохинон);
n = 2, aRed = aгх = 1; аОх = ах = 1;
φ = φ 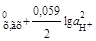 + φ
+ φ 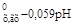 . (2.13)
. (2.13)
Связь константы равновесия химической реакции и стандартных электродных потенциалов выражается соотноше-нием
 (φ02 – φ01).n/0,0592 (Т = 298 К). (2.14)
(φ02 – φ01).n/0,0592 (Т = 298 К). (2.14)
Для концентрационных цепей уравнение Нернста (при отсутствии диффузионного потенциала) для электродов типа
Cu | Cu2+ ║ Cu2+ | Cu ; Ag, AgCl | HCl ║ HCl | Ag, AgCl
a1 a2 (a2 > a1) a1 a2 (a2 > a1)
имеет вид
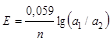 , (2.15)
, (2.15)
где а1 и а2 ─ активности ионов Cu2+ и Cl- соответственно.
Для электродов 2-го рода типа: Pt, H2 (P1) | HCl | Pt, H2 (P2), уравнение (2.15) преобразуется в уравнение
 (Р1/Р2), (2.16)
(Р1/Р2), (2.16)
где P1 и P2 - давления водорода, P1 > P2.
Для амальгамного элемента: Hg [Cd] (a1) | Cd2+ | Hg [Cd] (a2), (a2 > a1), уравнение Нернста имеет вид
 (а1/а2), (2.17)
(а1/а2), (2.17)
где a1 и a2 ─ активности металлического кадмия в амальгаме. Для элемента типа: Cd(ж) (a1 = 1) | Cd в расплаве солей | Cd в расплаве Cd – Sn (a2) уравнение (2.17) принимает вид
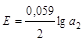 , (2.18)
, (2.18)
где a2 ─ активность кадмия в расплаве Cd – Sn.
Расчет ЭДС концентрационной цепи (например, серебряной, Ag | AgNO3 (а1) ║ AgNO3 (а2) | Ag,) производится по формуле
Е = 2. 0,059. l∞, 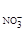 . lg(а1/а2) /(l∞,
. lg(а1/а2) /(l∞, 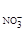 +l∞,
+l∞,  ) (2.19)
) (2.19)
где λ∞,Ag+ и λ∞, 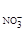 - подвижности аниона и катиона.
- подвижности аниона и катиона.
Термодинамические функции ΔG, ΔS, ΔH для электрохимических реакций рассчитывают по уравнениям:
ΔG = - nEF, (2.20)
 , (2.21)
, (2.21)
 , (2.22)
, (2.22)
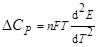 , (2.23)
, (2.23)
 , (2.24)
, (2.24)
где n – число электронов, участвующих в реакции; F – число Фарадея, Кл; E – ЭДС, В.
Задачи с решениями
электролит проводимость потенциал кинетика
1. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 М раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Вычислите ЭДС элемента.
Решение. Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы. Для этого из табл. [8], берем значения стандартных электродных потенциалов систем Zn2+|Zn (-0,76 В) и Pb2+|Pb (-0,13 В), а затем рассчитываем значение φ по уравнению Нернста: φZn/Zn2+ = -0,76+(0,059.lg0,1)/2 = =-0,79 В, φPb/Pb2+=-0,13+(0,059.lg0,02)/2=-0,18 В. Находим ЭДС элемента: Е = φ Pb/Pb2+ – φ Zn/Zn 2+ = -0,18+0,79 = 0,61.
Ответ:0,61 В.
2. Вычислите потенциал серебряного электрода в насыщенном растворе AgBr (ПР = 6.10-13), содержащем, кроме того, 0,1 моль/л бромида калия.
Решение. Запишем уравнение Нернста для системы Ag+|Ag: φ= φ0 + 0,059.lg[Ag+]. Значение φ0 для этой системы составляет 0,8 В (табл. [8]). Поскольку бромид калия полностью диссоциирован, то [Br-]=0,1 моль/л. Отсюда находим концентрацию ионов серебра: [Ag+] = ПРAgBr /[Br-] = 6.10-13/0,1 = = 6.10-12 моль/л. Теперь подставляем значения φ0 и [Ag+] в уравнение электродного потенциала: φ = 0,8 + 0,059.lg(6∙10-12) = = 0,14.
Ответ: 0,14 В.
3. Вычислите активность ионов Н+ в растворе, в котором потенциал водородного электрода равен 82 мВ.
Решение. Из уравнения φ = -0,059рН находим: рН = = 0,082/0,059 = 1,39. Следовательно, аН+ = 0,041.
Ответ: аН+ = 0,041 моль/л.
4. Рассчитайте стандартный электродный потенциал пары Cu2+|Cu+ по следующим данным: φ0Cu2+|Cu = 0,337 В, φ0Cu+|Cu = = 0,521 В.
Решение. Для реакции Cu2+ + 2е = Cu, ΔG0 = -nF Е0 = = −2.96485.0,337 = −65031 Дж.моль-1. Для реакции Cu+ + е = Cu, ΔG0 = −96485.0,521 = −50269 Дж.моль-1. Вычитая из первой реакции вторую, получим Cu2+ + е = Cu+ и, следовательно, ΔG0 = = −14762 Дж.моль-1, откуда Е0 = 0,153.
Ответ: Е0 = 0,153 В.
5. ΔН реакции Pb + Hg2Cl2 = PbCl2 + 2Hg, протекающей в гальваническом элементе, равно −94,2 кДж/моль при 298,2 К. ЭДС этого элемента возрастает на 1,45.10-4 В при повышении температуры на 1 К. Рассчитайте ЭДС элемента и ΔS при 298,2 К.
Решение.  = 2,96485.1,45.10-4 = = 28,0. ΔG = ΔН – ТΔS = nFE, откуда E = − (ΔН - ТΔS)/nF = = 0,5314.
= 2,96485.1,45.10-4 = = 28,0. ΔG = ΔН – ТΔS = nFE, откуда E = − (ΔН - ТΔS)/nF = = 0,5314.
Ответ: ΔS = 28,0 Дж/(моль.К); E = 0,5314 В.
6. Рассчитайте константу равновесия реакции Cd2+ + Zn = = Zn2+ + Cd, если φ0Cd2+/Cd = -403 В; φ0Zn2+/Zn = -0,763 В.
Р е ш е н и е. Константу равновесия вычисляем по уравнению:  (φ02 – φ01).n/0,0592. После подстановки данных получим
(φ02 – φ01).n/0,0592. После подстановки данных получим  = 12,16. Откуда К = 1,45.1012.
= 12,16. Откуда К = 1,45.1012.
Ответ: К = 1,45.1012.
|
из
5.00
|
Обсуждение в статье: Необходимые исходные сведения и основные уравнения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

