 |
Главная |
Кристаллизация малорастворимых веществ
Кристаллизация малорастворимых веществ представляет особый случай кристаллизации из растворов. Деление веществ на хорошо растворимые и малорастворимые носит условный характер. Обычно к малорастворимым относятся вещества, растворимость которых в воде меньше растворимости гипса (т.е., меньше 10 г/л). Отметим, что число соединений, имеющих указанную растворимость, достаточно велико; эти соединения осаждаются в виде кристаллов.
Отдельное рассмотрение процесса кристаллизации малорастворимых веществ не случайно и обусловлено рядом причин, главной из которых является отличие по способам создания пересыщения в процессе кристаллизации. При кристаллизации веществ с хорошей растворимостью для создания пересыщения обычно используются изотермический и изогидрический способы, а также выпаривание. Основным же способом создания пересыщения у малорастворимых веществ является проведение химических превращений.
Химические реакции осаждения подразделяются на две группы:
1. реакции присоединения, например взаимодействие аммиака и фосфорной кислоты с образованием моноаммонийфосфата
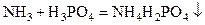
или пероксида водорода и метабората натрия с образованием пербората натрия
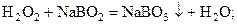
2. реакции обменного разложения, когда один из вновь образующихся компонентов является менее растворимым по сравнению с другим, и высаливается из раствора, например
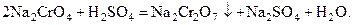
Вторая группа реакций получила более широкое распространение.
Кристаллизацию в результате химической реакции осаждения широко используют как в крупнотоннажных производствах (например, в производстве сульфата аммония из аммиака и серной кислоты), так и в небольших производствах (например, получение пербората натрия).
Другое важное отличие процессов кристаллизации хорошо растворимых и малорастворимых веществ связано с широтой концентрационного диапазона и степенью пересыщения в ходе кристаллизации. Кристаллизация хорошо растворимых веществ ведётся при малых величинах пересыщения, т.е. в условиях, близких к равновесным. Кристаллизация малорастворимых веществ ведётся при больших величинах пересыщения, т.е. при существенном удалении от равновесия. Так например, в случае плохо растворимых гидроксидов железа, аммония, хрома и др. степень пересыщения может составлять от нескольких единиц до 400000 % (мас.) и более.

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

