 |
Главная |
Анализ технической соли Мора
|
из
5.00
|
Способ взятия навески - отдельные навески.
| j 0 MnO4-/ Mn2+ = + 1,51 B | j 0 Fe3+ / Fe2+ = + 0,77 B | Dj = 1,51 - 0,77 = 0,74 B |
Химическая сущность
10(NH4)2Fe(SO4)2 + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + 10(NH4)2SO4 +
+ K2SO4 + 8H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | ||
| Fe2+ - 1e- ® Fe3+ | ||
| 2MnO4- + 10Fe2+ + 16H+ = 2Mn2+ + 10Fe3+ + 8H2O |
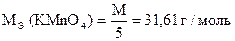





Условия титрования:
· среда сернокислая;
· на холоду, т.к. при нагревании Fe2+ окисляется кислородом воздуха до Fe3+ ;
· в присутствии H3PO4.
| |||
| |||
Фосфорная кислота связывает Fe3+ в бесцветный комплекс и окраска раствора не мешает определению момента эквивалентности (переходу окраски от бесцветной до бледно-розовой).
Fe2(SO4)3 + 4H3PO4 = 2H3[Fe(PO4) 2] + 3H2SO4
| Анализ лучше выполнять титрованием отдельных навесок, т.к. при способе пипетирования Fe2+ могут окисляться кислородом, растворенным в воде. По данным титрования вычисляют процентное содержание Fe и (NH4)2Fe(SO4)2×6H2O в образце. При анализе Fe3+ и железных руд после растворения навесок в кислоте раствор пропускают через редуктор, заполненный цинком (рис.1), для восстановления Fe3+ до Fe2+. 2Fe3+ + Zn = 2Fe2+ + Zn2+ Восстановленный раствор титруется перманганатом калия. |  рис 1. Редуктор
рис 1. Редуктор
|
Пример расчета
Навеска соли Мора 0,5027 г после растворения оттитрована 17,20 мл KMnO4.
T(KMnO4) = 0,001574 г/мл. Вычислить процентное содержание Fe и соли Мора в образце.
| Дано: m н = 0,5027 г T(KMnO4) = 0,001574 г/мл V (KMnO4) = 17,20 мл |


|
| w(Fe) = ? | w((NH4)2Fe(SO4)2×6H2O) = ? |


‚ ƒ „ …
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
2) Сколько моль-экв KMnO4 содержится в 17,20 мл раствора.
Столько же моль-экв Fe содержится в навеске.
3) Сколько г Fe содержится в навеске.
4) Сколько г Fe содержится в 1 г образца.
5) Сколько г Fe содержится в 100 г образца или w(Fe).
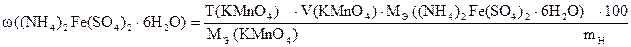
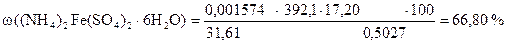
‚ ƒ „ …
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
Столько же моль-экв соли Мора оттитровано 1 мл KMnO4.
2) Сколько г соли Мора оттитровано 17,20 мл KMnO4.
Столько же г соли Мора содержится в навеске.
3) Сколько г соли Мора содержится в навеске.
4) Сколько г соли Мора содержится в 1 г образца.
5) Сколько г соли Мора содержится в 100 г образца или w((NH4)2Fe(SO4)2×6H2O).
Анализ технического сульфита натрия
Метод перманганатометрии применяют в сернокислой среде. Na2SO3 в кислой среде разлагается:
Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2
Чтобы предотвратить эту реакцию, применяют обратный порядок титрования, который называется реверсивным титрованием.
| Бюретку заполняют исследуемым раствором Na2SO3, а в коническую колбу отбирают пипеткой раствор KMnO4 и прибавляют большой избыток 2н H2SO4 (рис.2), т.к. часть H2SO4 расходуется на нейтрализацию раствора Na2SO3, который подвергается гидролизу. Na2SO3 + H2O NaHSO3 + NaOH (рН > 7 среда щелочная) |  Рис 2.
Рис 2.
|
Условия титрования:
· на холоду;
· среда сернокислая;
· титруют быстро до бледно-розовой окраски.
Химическая сущность
| j 0 MnO4-/ Mn2+ = + 1,51 B | j 0 SO42-/ SO32- = + 0,17 B | Dj = 1,51 - 0,17 = 1,34 B |
5Na2SO3 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | |
| SO32- + H2O - 2e- = SO42- + 2H+ | |
| 2MnO4- + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O |
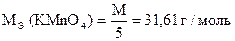


По данным титрования вычисляют процентное содержание Na2SO3 в образце.
Пример расчета
Навеска образца технического сульфита натрия 1,3385 г растворена в мерной колбе 100 мл. На титрование 10,00 мл раствора KMnO4 расходуется 9,20 мл приготовленного раствора сульфита натрия. Вычислить процентное содержание Na2SO3 в образце, если
Т(KMnO4) = 0,003161 г/мл.
| Дано: | ||
| m н = 1,3385 г Vк = 100,00 мл V (KMnO4) = 10,00 мл V (Na2SO3) = 9,20 мл | Т(KMnO4) = 0,003161 г/мл

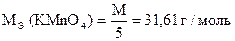
| |
| w (Na2SO3) = ? |

|

‚ ƒ „ … † ‡
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
2) Сколько моль-экв KMnO4 содержится в 10,00 мл раствора.
Столько же моль-экв Na2SO3 содержится в 9,20 мл раствора.
3) Сколько моль-экв Na2SO3 содержится в 1 мл раствора.
4) Сколько моль-экв Na2SO3 содержится в 100,00 мл раствора.
5) Сколько г Na2SO3 содержится в 100,00 мл раствора.
Столько же г Na2SO3 содержится в навеске.
6) Сколько г Na2SO3 содержится в 1 г образца.
7) Сколько г Na2SO3 содержится в 100 г образца или w (Na2SO3).
|
из
5.00
|
Обсуждение в статье: Анализ технической соли Мора |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

