 |
Главная |
Анализ пероксида водорода
|
из
5.00
|
Способ взятия навески - пипетирование.
H2O2 (H ¾ O ¾ O ¾ H)
Химическая связь ¾ O ¾ O ¾ непрочная.
Энергия связи ¾ O ¾ O ¾ в 2 раза меньше энергии связи O ¾ H.
Поэтому H2O2 вещество неустойчивое.
Пероксиды проявляют свойства окислителей и восстановителей.
| j 0 H2O2 / 2H2O = + 1,77 B | j 0 O2 / H2O2 = + 0,68 B |
Восстановительные свойства пероксид водорода проявляет только по отношению к сильным окислителям, например KMnO4 (j 0 MnO4-/ Mn2+ = + 1,51 B).
Химическая сущность
Dj = 1,51 - 0,68 = 0,83 B
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | |
| H2O2 - 2e- = O2 + 2H+ | |
| 2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2 + 8H2O |

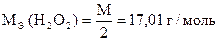
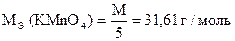
Условия титрования
· среда сернокислая;
· на холоду, т.к. H2O2 вещество неустойчивое.
Примеры расчета
Расчет массы навески
Какую навеску H2O2, содержащую ~ 3% H2O2 надо взять,
если Сн (KMnO4) = 0,05 моль/л, а объем мерной колбы 100 мл ?
| Дано: | |
| Сн (KMnO4) = 0,05 моль/л Vк = 100,00 мл | 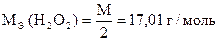 w (H2O2) = 3 %
w (H2O2) = 3 %
|
| m н = ? |
Сн (KMnO4) » Сн (H2O2)
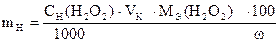

‚ ƒ „
1) Сколько моль-экв H2O2 содержится в 1 мл раствора.
2) Сколько моль-экв H2O2 содержится в 100,00 мл раствора.
3) Сколько г H2O2 содержится в 100,00 мл раствора.
4) Масса навески.
Навеску H2O2 взвешивают в бюксе с закрытой крышкой на аналитических весах. Количественно переносят в мерную колбу 100 мл, разбавляют холодной дистиллированной водой, доводят до метки, перемешивают и отбирают пипеткой аликвотную часть, подкисляют ~ 10 мл 2н H2SO4 и титруют стандартным раствором KMnO4 до бледно-розовой окраски.
По данным титрования вычисляют процентное содержание H2O2 в образце.
Расчет результатов анализа
Навеску пероксида водорода массой 2,5000 г перевели в мерную колбу 100 мл.
На титрование 10,00 мл полученного раствора израсходовали 14,50 мл KMnO4.
К0,1Н = 1,1200. Вычислить процентное содержание H2O2 в образце.
| Дано: | ||
| Vк = 100,00 мл Vn = 10,00 мл V (KMnO4) = 14,50 мл | m н = 2,5000 г
К0,1Н = 1,12
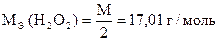
| |
| w (H2O2) = ? |


‚ ƒ „ … † ‡
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
2) Сколько моль-экв KMnO4 содержится в 14,50 мл раствора.
Столько же моль-экв Н2O2 содержится в 10,00 мл раствора.
3) Сколько моль-экв Н2O2 содержится в 1 мл раствора.
4) Сколько моль-экв Н2O2 содержится в 100,00 мл раствора.
5) Сколько г Н2O2 содержится в 100,00 мл раствора.
Столько же г Н2O2 содержится в навеске.
6) Сколько г Н2O2 содержится в 1 г образца.
7) Сколько г Н2O2 содержится в 100 г образца или w (Н2O2).
Анализ нитритов
Нитриты (KNO2, NaNO2, HNO2) методом перманганатометрии анализируют реверсивным титрованием, т.к. HNO2 и нитриты в кислой среде разлагаются с образованием оксидов азота
 2NO2- + 2H+ 2HNO2 ® NO + NO2 + H2O
2NO2- + 2H+ 2HNO2 ® NO + NO2 + H2O
Поэтому, чтобы избежать потерь, применяют обратный порядок титрования.
Способ взятия навески - пипетирование.
Химическая сущность
| j 0 MnO4-/ Mn2+ = + 1,51 B | j 0 NO3-/ NO2- = + 0,94 B | Dj = 1,51 - 0,94 = 0,57 B |
5NaNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | |
| NO2- + H2O - 2e- = NO3- + 2H+ | |
| 2MnO4- + 5NO2- + 6H+ = 2Mn2+ + 5 NO3- + 3H2O |
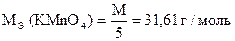

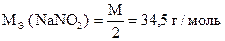
В бюретку наливают нейтральный раствор нитрита, а в коническую колбу - кислый раствор KMnO4, t ~ 40 °С (при более высокой температуре нитриты разлагаются).
По данным титрования вычисляют процентное содержание NaNO2 в образце.
Пример расчета
Навеска нитрита натрия 0,2746 г растворена в мерной колбе 200 мл. Этим раствором титруют 20,00 мл KMnO4. Сн (KMnO4) = 0,04935 моль/л. Объем раствора по бюретке равен 26,90 мл. Вычислить процентное содержание NaNO2 в образце.
| Дано: | ||
| m н = 0,2746 г Vк = 200,00 мл V (KMnO4) = 20,00 мл V (NaNO2) = 26,90 мл |
Сн (KMnO4) = 0,04935 моль/л

| |
| w (NaNO2) = ? |

|

‚ ƒ „ … † ‡
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
2) Сколько моль-экв KMnO4 содержится в 20,00 мл раствора.
Столько же моль-экв NaNO2 содержится в 26,90 мл раствора.
3) Сколько моль-экв NaNO2 содержится в 1 мл раствора.
4) Сколько моль-экв NaNO2 содержится в 200,00 мл раствора.
5) Сколько г NaNO2 в содержится в 200,00 мл раствора.
Столько же г NaNO2 содержится в навеске.
6) Сколько г NaNO2 содержится в 1 г образца.
7) Сколько г NaNO2 содержится в 100 г образца или w (NaNO2).
|
из
5.00
|
Обсуждение в статье: Анализ пероксида водорода |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

