 |
Главная |
Анализ окислителей методом перманганатометрии
|
из
5.00
|
Методом перманганатометрии можно анализировать окислители: KMnO4, K2Cr2O7, MnO2, KClO3, KBrO3 и др.
Прямое титрование сильных окислителей перманганатом калия невозможно, т.к. вещества между собой не реагируют.
j 0 MnO4-/ Mn2+ = + 1,51 B
j 0 Cr2O72-/ 2Cr3+ = + 1,33 B
j 0 ClO3- / Cl- = + 1,45 B
В данных анализах применяют способ обратного титрования (титрование по остатку).
Сущность этого способа состоит в том, что используют два стандартных раствора: раствор KMnO4 и раствор восстановителя (раствор соли Мора или раствор щавелевой кислоты).
Аликвоту раствора (объем пипетки) или точно взвешенную и растворенную навеску окислителя восстанавливают стандартным раствором восстановителя, взятом в точном избытке, затем непрореагировавший остаток восстановителя титруют стандартным раствором перманганата калия.
Например, минерал пиролюзит содержит MnO2.
На аналитических весах взвешивают навеску MnO2, растворяют ее в серной кислоте и обрабатывают точно отмеренным объемом, взятом в избытке, стандартного раствора щавелевой кислоты. Часть щавелевой кислоты вступает в реакцию с MnO2 и полностью его восстанавливает, а остаток щавелевой кислоты титруют стандартным раствором KMnO4.
По данным титрования вычисляют процентное содержание MnO2 в образце.
Примеры расчета
Задача 1
Навеска пиролюзита массой 0,4036 г обработана 50,00 мл щавелевой кислоты (К0,1Н = 0,9750). Избыток щавелевой кислоты оттитрован 15,90 мл KMnO4 (К0,1Н = 1,1250). Вычислить процентное содержание MnO2 в образце.
Химическая сущность
MnO2 + H2C2O4 + H2SO4 = MnSO4 + 2CO2 + 2H2O + [H2C2O4]
| |||||||
| |||||||
| |||||||
|
| MnO2 + 4H+ + 2e- = Mn2+ + 2H2O | |
| H2C2O4 - 2e- = 2CO2 + 2H+ | |
| MnO2 + H2C2O4 + 2H+ = Mn2+ + 2CO2 + 2H2O |
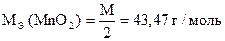
5H2C2O4 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | |
| H2C2O4 - 2e- = 2CO2 + 2H+ | |
| 2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8H2O |
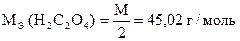
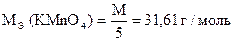
Дано:
m н = 0,4036 г
V (H2C2O4) = 50,00 мл
К0,1Н (H2C2O4) = 0,9750
V (KMnO4) = 15,90 мл
К0,1Н (KMnO4) = 1,1250
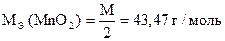
|
| w (MnO2) = ? |
Способ расчета через избыточный объем.
1. Сколько мл H2C2O4 содержится в остатке.
Столько же мл H2C2O4 прореагировало с 15,90 мл KMnO4.
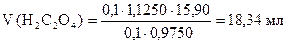
2. Сколько мл H2C2O4 израсходовано на восстановление MnO2.
50,00 - 18,34 = 31,66 мл
3. Сколько процентов MnO2 в образце.
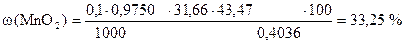
‚ ƒ „ …
1) Сколько моль-экв H2C2O4 содержится в 1 мл раствора.
2) Сколько моль-экв H2C2O4 содержится в 31,66 мл раствора.
Столько же моль-экв MnO2 содержится в навеске.
3) Сколько г MnO2 содержится в навеске.
4) Сколько г MnO2 содержится в 1 г образца.
5) Сколько г MnO2 содержится в 100 г образца или w (MnO2).
Способ расчета по количеству моль-экв.
1. Сколько моль-экв H2C2O4 содержится в 50,00 мл.
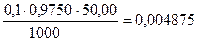
2. Сколько моль-экв KMnO4 содержится в 15,90 мл.
Столько же моль-экв H2C2O4 содержится в остатке.
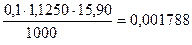
3. Сколько моль-экв H2C2O4 вступило в реакцию с MnO2.
Столько же моль-экв MnO2 содержится в навеске.
0,004875 - 0,001788 = 0,003087
4. Сколько процентов MnO2 в образце.
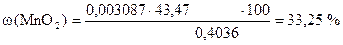
‚ ƒ
1) Сколько г MnO2 содержится в навеске.
2) Сколько г MnO2 содержится в 1 г образца.
3) Сколько г MnO2 содержится в 100 г образца или w (MnO2).
Этот способ расчета можно свести к одной формуле:
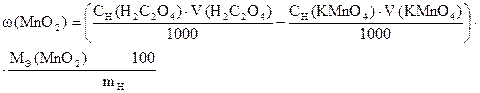
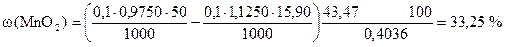
ƒ ‚ „ … †
1) Сколько моль-экв H2C2O4 содержится в 50,00 мл.
2) Сколько моль-экв KMnO4 содержится в 15,90 мл.
Столько же моль-экв H2C2O4 содержится в остатке.
3) Сколько моль-экв H2C2O4 вступило в реакцию с MnO2.
Столько же моль-экв MnO2 содержится в навеске.
4) Сколько г MnO2 содержится в навеске.
5) Сколько г MnO2 содержится в 1 г образца.
6) Сколько г MnO2 содержится в 100 г образца или w (MnO2).
Задача 2
Для анализа на содержание хрома 1,0170 г образца растворено и окислено.
На восстановление образовавшейся дихромовой кислоты взято 40,00 мл раствора соли Мора. На титрование избытка восстановителя израсходовано 5,02 мл раствора KMnO4 .
СН (KMnO4) = 0,02394 моль/л
10,00 мл раствора соли Мора эквивалентны 9,63 мл раствора KMnO4.
Вычислить процентное содержание хрома в образце.
| Дано: | ||
m н = 1,0170 г
V((NH4)2Fe(SO4)2×6H2O) = 40,00 мл
V (KMnO4) = 5,02 мл
СН(KMnO4) = 0,02394 моль/л
10,00 мл соли Мора эквивалентно 9,63 мл KMnO4 ("глухой опыт")
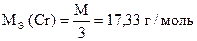
| ||
| w (Cr) = ? |
H2Cr2O7 + 6(NH4)2Fe(SO4)2 + 6H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + 6(NH4)2SO4 + 7H2O +
+ [(NH4)2Fe(SO4)2]
|
|
| Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O | |
| Fe2+ - 1e- = Fe3+ | |
| Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O |
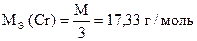
|
10(NH4)2Fe(SO4)2 + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + 10(NH4)2SO4 +
+ K2SO4 + 8H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | ||
| Fe2+ - 1e- = Fe3+ | ||
| 2MnO4- + 10Fe2+ + 16H+ = 2Mn2+ + 10Fe3+ + 8H2O |
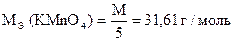
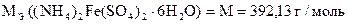
Способ расчета по количеству моль-экв.
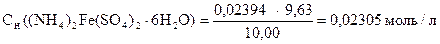

ƒ ‚ „ … †
1) Сколько моль-экв соли Мора содержится в 40,00 мл раствора.
2) Сколько моль-экв KMnO4 содержится в 5,02 мл раствора.
Столько же моль-экв соли Мора содержится в остатке.
3) Сколько моль-экв соли Мора вступило в реакцию с H2Cr2O7.
Столько же моль-экв Cr содержится в навеске.
4) Сколько г Cr содержится в навеске.
5) Сколько г Cr содержится в 1 г образца.
6) Сколько г Cr содержится в 100 г образца или w (Cr).
Способ расчета по "глухому опыту".
1. Сколько мл KMnO4 эквивалентно 40,00 мл соли Мора.
10,00 мл соли Мора эквивалентно 9,63 мл KMnO4
40,00 мл соли Мора эквивалентно Х
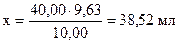
2. Сколько мл KMnO4 эквивалентно содержанию Cr.
38,52 - 5,02 = 33,50 мл
3. Сколько процентов Cr в образце.
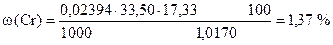
ƒ ‚ „ …
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
2) Сколько моль-экв KMnO4 содержится в 33,50 мл раствора.
Столько же моль-экв Cr содержится в навеске.
3) Сколько г Cr содержится в навеске.
4) Сколько г Cr содержится в 1 г образца.
5) Сколько г Cr содержится в 100 г образца или w (Cr).
Задача 3
Навеска образца хлората калия 0,8604 г растворена в мерной колбе 100 мл. 10,00 мл полученного раствора обработано 18,00 мл раствора соли Мора (К0,1Н = 1,3200). На титрование избытка соли Мора израсходовано 7,00 мл раствора KMnO4 (К0,1Н = 1,2000). Вычислить процентное содержание KClO3 в образце.
Химическая сущность
KClO3 + 6(NH4)2Fe(SO4)2 + 3H2SO4 = KCl + 3Fe2(SO4)3 + 6(NH4)2SO4 + 3H2O +
|
+ [остаток соли Мора]
| Fe2+ - 1e- = Fe3+ | |
| ClO3- + 6H+ + 6e- = Cl- + 3H2O | |
| ClO3- + 6Fe2+ + 6H+ = 6Fe3+ + Cl- + 3H2O |
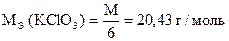
10(NH4)2Fe(SO4)2 +2KMnO4 +8H2SO4 = 5Fe2(SO4)3 +2MnSO4 +10(NH4)2SO4 +K2SO4 +8H2O
|
| Fe2+ - 1e- = Fe3+ | ||
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | ||
| 2MnO4- + 10Fe2+ + 16H+ = 2Mn2+ + 10Fe3+ + 8H2O |
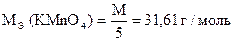
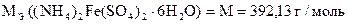
| Дано: | ||
| m н = 0,8604 г Vк = 100,00 мл Vn = 10,00 мл | V ((NH4)2Fe(SO4)2×H2O) = 18,00 мл
К0,1Н ((NH4)2Fe(SO4)2×H2O) = 1,3200
V (KMnO4) = 7,00 мл
К0,1Н (KMnO4) = 1,2000
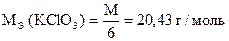
| |
| w (KClO3) = ? |
Способ расчета по количеству моль-экв.
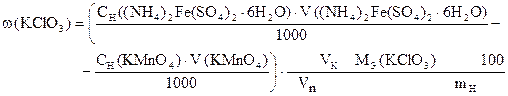
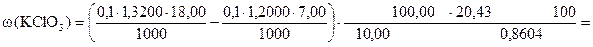
ƒ ‚ „ … † ‡ ˆ
= 36,47 %
1) Сколько моль-экв соли Мора содержится в 18,00 мл раствора.
2) Сколько моль-экв KMnO4 содержится в 7,00 мл раствора.
Столько же моль-экв соли Мора содержится в остатке.
3) Сколько моль-экв соли Мора вступило в реакцию с KClO3.
Столько же моль-экв KClO3 содержится в 10,00 мл раствора.
4) Сколько моль-экв KClO3 содержится в 1 мл раствора.
5) Сколько моль-экв KClO3 содержится в 100,00 мл раствора.
6) Сколько г KClO3 содержится в 100,00 мл раствора.
Столько же г KClO3 содержится в навеске.
7) Сколько г KClO3 содержится в 1 г образца.
8) Сколько г KClO3 содержится в 100 г образца или w(KClO3).
|
из
5.00
|
Обсуждение в статье: Анализ окислителей методом перманганатометрии |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

