 |
Главная |
Гибридизация атомных орбиталей
|
из
5.00
|
Для объяснения фактов, когда атом образует большее число связей, чем число неспаренных электронов в его основном состоянии (например, атом углерода), используется постулат о гибридизации близких по энергии атомных орбиталей. Гибридизация АО происходит при образовании ковалентной связи, если при этом достигается более эффективное перекрывание орбиталей. Гибридизация атома углерода сопровождается его возбуждением и переносом электрона с 2s- на 2р-АО:

Основное и возбужденное состояния атома углерода.
Гибридизация АО - это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии.
Например, смешение 2s-АО с 2p-АО дает две гибридные 2sp-АО:

АО с большой разницей в энергии (например, 1s и 2р) в гибридизацию не вступают. В зависимости от числа участвующих в гибридизации p-АО возможны следующие виды гибридизации:
для атомов углерода и азота - sp3, sp2 и sp;
для атома кислорода - sp3, sp2;
для галогенов - sp3.
Гибридная АО асимметрична и сильно вытянута в одну сторону от ядра (форма неправильной восьмерки).

В отличие от негибридных s- или р-АО, она имеет одну большую долю, которая хорошо образует химическую связь, и малую долю, которую обычно даже не изображают. Гибридизованные АО при взаимодействии с орбиталями различных типов (s-, р- или гибридными АО) других атомов обычно дают s-МО, т.е. образуют s-связи. Такая связь прочнее связи, образованной электронами негибридных АО, за счет более эффективного перекрывания.
3.3.1. sp3-Гибридизация (тетраэдрическая).
Одна s- и три р-орбитали смешиваются, и образуются четыре равноценные по форме и энергии sp3-гибридные орбитали.
Орбитальная модель атома в sp3-гибридизованном состоянии.

Для атома углерода и других элементов 2-го периода этот процесс происходит по схеме:
2s + 2px + 2py + 2pz = 4 (2sp3)

Схема sp3-гибридизации атомных орбиталей.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов.
Впервые идею о направленности единиц сродства (валентностей) атома углерода по углам тетраэдра независимо друг от друга выдвинули в 1874 г. Вант-Гофф и Ле Бель.
sp3-Орбитали могут образовывать четыре s-связи с другими атомами или заполняться неподеленными парами электронов.
А как наглядно изобразить пространственное строение атома в sp3-состоянии на рисунке?
В этом случае sp3-гибридные орбитали изображают не электронными облаками, а прямыми линиями или клиньями в зависимости от пространственной ориентации орбитали. Такое схематическое изображение используется при написании стереохимических (пространственных) формул молекул.

Переход от орбитальной модели (а) к пространственной формуле (б).
На примере молекулы метана показаны объемные модели и пространственная (стереохимическая) формула молекулы с sp3-углеродным атомом.



Модель молекулы метана
sp3-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 4.
Углерод в sp3-гибридном состоянии встречается в простом веществе - алмазе . Это состояние характерно для атомов С, N, O и др., соединенных с другими атомами одинарными связями (sp3-атомы выделены красным цветом):
СH4, RCH3, NH3, RNH2, H2O, ROH, R2O;
а также анионам типа:
R3C:-, RO-.
Следствием тетраэдрического строения sp3-атома является возможность существования двух оптических стереоизомеров у соединения, содержащего такой атом с четырьмя разными заместителями (Вант-Гофф, Ле Бель, 1874).
3.3.2. sp2-Гибридизация (плоскостно-тригональная).
Одна s- и две p-орбитали смешиваются, и образуются три равноценные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° (выделены синим цветом). Они могут образовывать три s-связи. Третья р-орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей. Эта р-АО участвует в образовании p-связи.
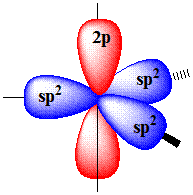
Для элементов 2-го периода процесс sp2-гибридизации происходит по схеме:
2s + 2px + 2py = 3 (2sp2) 2pz-АО в гибридизации не участвует.

Для изображения пространственного строения атомов в sp2-состоянии используются те же приемы, что и в случае sp3-атомов:

Переход от орбитальной модели атома в sp2-гибридизированном состоянии (а) к пространственной формуле (б). Строение молекул с sp2-атомами отражают их модели:



Модели молекулы этилена
sp2-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 3
Углерод в sp2-гибридном состоянии образует простое вещество графит. Это состояние характерно для атомов С, N, O и др. с двойной связью (sp2-атомы выделены красным цветом):
H2C=CH2, H2C=CHR, R2C=NR, R-N=N-R, R2C=O, R-N=O,
а также для катионов типа
R3C+ и свободных радикалов R3C ·.
|
из
5.00
|
Обсуждение в статье: Гибридизация атомных орбиталей |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

