 |
Главная |
Анализ и классификация анионов
|
из
5.00
|
Анализ и классификация катионов
Для определения катионов разработаны и применяются на практике такие классификации, как: сероводородная (сульфидная); кислотно-основная; гидроксидно-пероксидная; фосфатно-аммиачная и др. Под аналитической классификацией катионов понимают выделение в осадок небольших групп ионов из смеси путем последовательного воздействия системы групповых реагентов.
В основе любой классификации лежит принцип сходства химических свойств элементов: способность ряда ионов образовывать малорастворимые соединения (осадки). В качестве реагентов подбираются вещества, которые в минимальной степени в дальнейшем будут влиять на ход определения, либо легко могут быть удалены. В первую очередь это кислоты, гидроксиды и соли аммония.
Сероводородная классификация одна из самых простых по структуре (таблица 2.1), однако ее применение в настоящее время ограничено из-за использования высокотоксичного сероводорода. Другие методы анализа были разработаны с целью замены токсичных реагентов на более безопасные и состоят обычно из 5 или 6 групп катионов.
В реальной практике анализ выполняется на основе комплексного подхода: выбирают те реактивы, реагенты и схемы его проведения, которые позволяют достичь желаемого результата наиболее экономным путем.
Согласно сероводородной классификации, как видно из таблицы 2.1, все катионы разбиты на 5 аналитических групп, осаждение которых выполняется с помощью системы групповых реагентов в следующей последовательности:
Группа: V IV III II I
реагент: 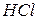 ®
®  ®
®  ®
®  ® нет
® нет
рН: 


 .
.
Определение начинают с выделения и отделения 5-й группы катионов, образующих нерастворимые в воде и кислотах хлориды. Затем в среде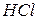 (рН=
(рН= )проводят осаждение 4-й группы катионов в виде сульфидов, устойчивых как в кислой, так и в нейтральной среде. Для последующих с помощью аммиачного буфера изменяют кислотность среды на щелочную и последовательно выделяют в осадок 3-ю и 2-ю группы катионов в виде соответствующих сульфидов, гидроксидов и карбонатов.
)проводят осаждение 4-й группы катионов в виде сульфидов, устойчивых как в кислой, так и в нейтральной среде. Для последующих с помощью аммиачного буфера изменяют кислотность среды на щелочную и последовательно выделяют в осадок 3-ю и 2-ю группы катионов в виде соответствующих сульфидов, гидроксидов и карбонатов.
Таким образом, врастворе после воздействия системы групповых реагентов остаются только катионы 1-й аналитической группы, которая не осаждается полностью ни одним из реагентов.
Дальнейшая идентификация катионов в группах основана на различие их растворимости, что позволяет разделить группы на подгруппы. Так в 4-й группе катионов выделяют подгруппу меди и подгруппу мышьяка; в 3-й группе – это подгруппы цинка и алюминия. Определение индивидуальных катионов внутри групп и подгрупп выполняют комбинацией дробного и систематического метода.
 Таблица 2.1 – Сероводородная классификация катионов
Таблица 2.1 – Сероводородная классификация катионов
| Аналити-ческая группа | Катионы | Условия осаждения | Групповой реагент | Соединения, образующие осадок | Характеристика группы |
| первая | 1) подгруппа аммония:  , , 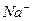 , ,  .
2) подгруппа магния: .
2) подгруппа магния:  и др. и др.
| - | нет | - | Сульфиды и карбонаты растворимы в воде, карбонат магния растворим в растворах солей аммония |
| вторая |  , ,  , , 

| 
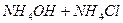
| 
| 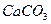 , ,  , , 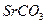
| Сульфиды растворимы, а карбонаты нерастворимы в воде |
| третья | 1) подгруппа алюминия:  , ,  .
2) подгруппа цинка: .
2) подгруппа цинка:  , ,  , ,  , ,  , ,  , ,  и др. и др.
|  буфер
буфер

| 
|  , , 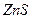 , ,  , ,  , ,  , ,  , ,  , , 
| Сульфиды (или гидроксиды) нерастворимы в воде и растворимы в разбавленных минеральных кислотах |
| четвёртая | 1) подгруппа меди:   , ,  , ,  , ,  и др.
2) подгруппа мышьяка: и др.
2) подгруппа мышьяка:  , , 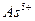 , ,  , ,  , ,  , ,  и др. и др.
| 
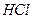
| H2S |  , ,  , ,  , ,  , ,  , , 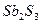 , ,  , , 
| Сульфиды нерастворимы в разбавленных кислотах, сульфиды  подгруппы растворимы в подгруппы растворимы в  с образованием аммиакатов, сульфиды с образованием аммиакатов, сульфиды  подгруппы растворимы в полисуль-фидах с образованием тио-солей подгруппы растворимы в полисуль-фидах с образованием тио-солей
|
| пятая |  , , 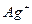 , , 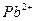 , ,  , , 
| 
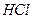
| 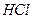
|  , ,  , ,  , , 
| Хлориды и сульфиды нерастворимы в воде и разбавленных минеральных кислотах |
Анализ и классификация анионов
Достаточно строгой аналитической классификации анионов не разработано. Нумерация групп анионов и применяемые реагенты в различных источниках сильно варьируют, как и количество выделяемых групп. Чаще всего их разделяют на три аналитические группы в зависимости от образования осадков с хлоридом бария и нитратом серебра (табл. 2.2).
Таблица 2.2 – Классификация анионов
| Аналитическая группа | Анионы | Групповой реагент | Характеристика группы |

| 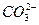 , ,  , ,  , ,  , ,  и др. и др.
| 
| Соли бария и серебра нерастворимы в воде, соли серебра растворимы в кис-лотах |

|  , ,  , ,  , ,  , ,  и др. и др.
|  в среде
в среде 
| Соли серебра нерастворимы в воде и разбавленных кислотах, соли бария растворимы в воде |

|  , ,  , , 
| нет | Соли бария и серебра раст-воримы в воде |
В предложенной классификации определение анионов, в отличии от катионов, начинают с 1-й группы, так как некоторые анионы ее способны реагировать с нитратом серебра, образуя неустойчивые осадки. Третья группа может анализироваться совместно как с 1-й, так и со 2-й группой. Анионы в меньшей степени мешают обнаружению друг друга, поэтому при их анализе чаще используют дробный метод, а к систематическому анализу прибегают только в более сложных случаях, например, при подозрении на присутствие трудно растворимых солей боратов или силикатов. Групповые реагенты используют в основном для предварительного обнаружения групп.
Классификацию анионов по окислительно-восстановительным свойствам также широко применяется для их открытия. Эти реакции полезны при совместном определении дробным способом сульфат- и сульфит-ионов; нитрат- и нитрит-ионов в смеси солей. В качестве таких примеров можно привести реакции анионов с перманганатом калия. Так  и
и  окисляются
окисляются 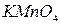 до элементарного хлора и брома соответственно,
до элементарного хлора и брома соответственно,  - до
- до  .
.
3 Приборы и реактивы
Штатив с пробирками, держатель пробирок, фильтровальная бумага, газовая горелка, универсальная индикаторная бумага.
Растворы солей, содержащие ионы: 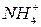 ,
,  ,
,  ,
, 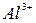 ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 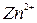 ,
, 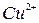 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 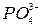 ,
,  ,
,  ,
,  .
.
Жидкие реактивы: 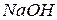 (
(  и
и 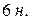 ),
),  ,
,  ,
,  ,
, 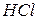 ,
, 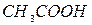 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 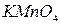 ,
,  ,
,  ,
,  , ализарин (1,2-диоксиантрахинон), реактивы Неслера (смесь
, ализарин (1,2-диоксиантрахинон), реактивы Неслера (смесь  с
с  ), Ильинского (1-нитрозо-2-нафтол), Чугаева (диметилглиоксим).
), Ильинского (1-нитрозо-2-нафтол), Чугаева (диметилглиоксим).
Порошкообразные реактивы: металлический  (или
(или  ),
),  .
.
4 Указания по технике безопасности
Смотрите на стр. 4 (лабораторная работа 1).
5 Методика и порядок выполнения работы
Используя пробирный анализ, выполнить определение катионов и анионов в растворах индивидуальных солей согласно методике (табл. 2.3, графы 2 и 3). При необходимости растворы осторожно подогреть на газовой горелке, не допуская выброса жидкости.
Запись данных опыта. Отчет оформить в виде приведенной ниже таблицы 2.3, в которой необходимо указать цвет исходных растворов (графа 1), наблюдаемые Вами аналитические признаки (графа 4). Уравнения соответствующих реакций записать в ионной и молекулярной формах, а окислительно-восстановительные реакции уровнять методом полуреакции также в графе 4.
Таблица 2.3 – Качественные реакции катионов и анионов
в растворах индивидуальных солей
| Опреде-ляемый ион; цвет раствора | Условия проведения | Реагент | Аналитический признак, уравнение реакции |
| РЕАКЦИИ КАТИОНОВ | |||

| Внести 2-3 к. 2н раствора  (среда) и 1-2 к. ализарина (реагент). Пробирку нагреть. После охлаждения внести несколько капель (среда) и 1-2 к. ализарина (реагент). Пробирку нагреть. После охлаждения внести несколько капель 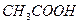 (до полного изменения окраски). (до полного изменения окраски).
| ализарин | Укажите цвет
раствора до и после добавления 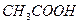
|

| Среда нейтральная | 
| |

| Среда кислая: 1-2 капли 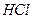
| 
| |

| Среда кислая: 4-5 капель 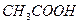
| Реактив Ильинского | |

| Среда щелочная: 2-3 к. 
| Реактив Чугаева | |

| Среда нейтральная; пробирку нагреть | 
| |

| среда нейтральная | 
| |
| РЕАКЦИИ АНИОНОВ | |||

| реакция с групповым реагентом (малоселективная) выполняется в кислой (1 – 2 кап.  ) или нейтральной среде ) или нейтральной среде
| 
|  – –
|

| 
| ||

|  – –
| ||

| Среда нейтральная | 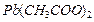
| |

| Среда нейтральная | 
| |
 (добавить в последнюю очередь)
(добавить в последнюю очередь)
| Среда кислая: 4-5 капель 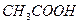
| 
| |

| Среда кислая:
2-3 капли 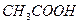
|  (кристаллический) (кристаллический)
|
6 Содержание отчета и его форма (см стр. 8)
7 Вопросы для защиты работы
1. Приведите основные общепризнанные классификации катионов. Какие групповые реагенты в них используют?
2. Какой принцип положен в основе классификации катионов по группам и подгруппам?
3. На чем основана сероводородная классификация катионов? В чем ее достоинства и недостатки?
4. Охарактеризуйте аналитические группы. В какой последовательности проводится разделение катионов?
5. Какова характерная особенность катионов, входящих в 3-ю группу, в 1-ю и 2-ю группы? Объясните, почему 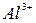 и
и  переводят в осадок групповым реагентом в виде гидроксидов? Напишите соответствующие уравнения реакций.
переводят в осадок групповым реагентом в виде гидроксидов? Напишите соответствующие уравнения реакций.
6. К зеленому раствору смеси катионов добавили 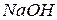 и
и  и нагрели. Какой катион присутствует в растворе, если его окраска стала желтой? Как изменилась степень окисления этого иона? Приведите уравнение реакции.
и нагрели. Какой катион присутствует в растворе, если его окраска стала желтой? Как изменилась степень окисления этого иона? Приведите уравнение реакции.
7. При добавлении к раствору кристаллического роданида калия или аммония появляется синяя окраска, неисчезающая при добавлении 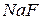 . Определите катион, присутствующий в растворе. Напишите уравнение реакции с
. Определите катион, присутствующий в растворе. Напишите уравнение реакции с  .
.
8. Какой катион присутствует в растворе, если выпал осадок синего цвета при добавлении: а) , б)
, б)  ? Приведите тривиальные названия образовавшихся соединений.
? Приведите тривиальные названия образовавшихся соединений.
9. Какие катионы можно открыть действием реагента  ? В каких аналитических группах находятся эти ионы? Запишите уравнения протекающих реакций с указанием аналитических признаков.
? В каких аналитических группах находятся эти ионы? Запишите уравнения протекающих реакций с указанием аналитических признаков.
10. При действии на раствор бихроматом калия (  ) выпадает желтый осадок. При добавлении к этому же раствору карбоната аммония образуется белый осадок, растворимый в кислотах. Какой катион присутствует в растворе? Напишите уравнение реакции.
) выпадает желтый осадок. При добавлении к этому же раствору карбоната аммония образуется белый осадок, растворимый в кислотах. Какой катион присутствует в растворе? Напишите уравнение реакции.
11. Какой катион с солями роданидов дает кроваво красный раствор, который обесцвечивается при добавлении фосфат- или фторид-ионов? Напишите уравнение реакции этого иона с  .
.
12. На каком принципе основано определение анионов? В какой последовательности определяются анионы традиционным способом?
13. Какой анион  группы определяется по обесцвечиванию перманганата калия в кислой среде?
группы определяется по обесцвечиванию перманганата калия в кислой среде?
14. Какие свойства осадков анионов 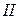 группы позволяют их идентифицировать? Напишите уравнения реакций этих анионов с групповыми реагентами и при их идентификации.
группы позволяют их идентифицировать? Напишите уравнения реакций этих анионов с групповыми реагентами и при их идентификации.
15. Катион какой группы можно использовать для открытия  аналитической группы анионов?
аналитической группы анионов?
16. Каким реактивом можно определить и отделить фосфат-ионы из раствора? Для чего еще можно использовать раствор, содержащий  ?
?
17. При добавлении к сухой соли концентрированной  выделяется бесцветный газ с резким запахом, который с раствором
выделяется бесцветный газ с резким запахом, который с раствором  дает осадок белого цвета, растворимый в
дает осадок белого цвета, растворимый в  . Определите анион. Напишите уравнения реакций в ионной и молекулярной формах.
. Определите анион. Напишите уравнения реакций в ионной и молекулярной формах.
18. При добавлении к сухой соли раствора 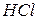 выделяется бесцветный газ, который, пройдя через известковую воду, вызывает ее помутнение или образование осадка белого цвета. Какой анион присутствует в растворе? Напишите уравнения реакций в ионной и молекулярной форме.
выделяется бесцветный газ, который, пройдя через известковую воду, вызывает ее помутнение или образование осадка белого цвета. Какой анион присутствует в растворе? Напишите уравнения реакций в ионной и молекулярной форме.
19.  дает с раствором желтый, нерастворимый в гидроксиде аммония, осадок. С этим же раствором
дает с раствором желтый, нерастворимый в гидроксиде аммония, осадок. С этим же раствором  образует осадок интенсивно желтого цвета. Какой анион присутствует в растворе? Обладает ли этот ион окислительно-восстановительными свойствами? Ответ подтвердите уравнениями соответствующей реакции.
образует осадок интенсивно желтого цвета. Какой анион присутствует в растворе? Обладает ли этот ион окислительно-восстановительными свойствами? Ответ подтвердите уравнениями соответствующей реакции.
20. При добавлении нитрата серебра в растворе образуется осадок светло-желтого цвета, частично растворимый в  . При действии на эту же соль
. При действии на эту же соль 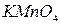 в кислой среде выделяется тяжелый газ с характерным запахом. Какой анион находится в растворе? Напишите уравнения протекающих реакций.
в кислой среде выделяется тяжелый газ с характерным запахом. Какой анион находится в растворе? Напишите уравнения протекающих реакций.
21. При добавлении нитрата серебра к раствору образуется осадок белого цвета, растворимый в гидроксиде аммония. С катионами какой группы он может вступать в реакцию с образованием осадков? Приведите примеры. Какой анион находится в растворе? Напишите уравнения реакций в ионной и молекулярной формах.
22. Какие анионы способны обесцвечивать растворы перманганата калия и иода? Каков в данном случае тип реакций? Приведите уравнение одной из таких реакций в ионной и молекулярной формах?
23. Какие анионы можно определить по выделению газа? Приведите примеры таких реакций. Какими характерными признаками обладает выделившийся газ?
ЛАБОРАТОРНАЯ РАБОТА 3
|
из
5.00
|
Обсуждение в статье: Анализ и классификация анионов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

