 |
Главная |
Пропись качестве6нных реакций катионов и анионов в растворах индивидуальных солей
|
из
5.00
|
Приложение № 1
Таблица 1. – Способы проведения качественных реакций
| Способ проведе-ния реакции | Опреде-ляемый ион | Порядок выполнения | Аналитический признак, уравнение реакции |
| Капельный | 
| В центр фильтровальной бумаги нанести 1–2 капли раствора  и 1–2 капли реагента и 1–2 капли реагента  . В центр образовавшегося пятна внести 1 каплю раствора, содержащего ионы . В центр образовавшегося пятна внести 1 каплю раствора, содержащего ионы  . .
| Цвет пятна: черно-серый.
1. 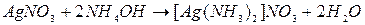 ;
2. ;
2. 
|
| Экстрак-ционный | 
| К 1 мл раствора, содержащего  , добавить ацетатный буфер (внести по 10 к. реактивов , добавить ацетатный буфер (внести по 10 к. реактивов  и и  ), а затем 5 к. дитизона (реагент). Пробирку закрыть и сильно встряхнуть. Дать расслоиться фазам. ), а затем 5 к. дитизона (реагент). Пробирку закрыть и сильно встряхнуть. Дать расслоиться фазам.
| Цвет фазы экстрагента (  ): алый, в виде кольца вверху пробирки. Внизу возможно выпадение капель красного цвета. ): алый, в виде кольца вверху пробирки. Внизу возможно выпадение капель красного цвета.
|
| Способ проведе-ния реакции | Опреде-ляемый ион | Порядок выполнения | Аналитический признак, уравнение реакции |
| Микро-кристалло-скопичес-кий | 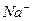
| На предметное стекло поместить 2-3 к. раствора соли натрия, подсушить и после охлаждения добавить 1 к. раствора уранилацетата цинка: 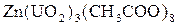 (реагент). Рассмотрите кристаллы под микроскопом и зарисуйте их. (реагент). Рассмотрите кристаллы под микроскопом и зарисуйте их.
| Цвет кристаллов: лимонный
Форма кристаллов: тетраэдр.

|
| Микро-кристал-лоскопи-ческий | 
| На предметное стекло поместить 2–3 к. раствора соли кальция. Добавить 1–2 к. раствора  (реагент) и подсушить. Рассмотреть под микроскопом полученный препарат. (реагент) и подсушить. Рассмотреть под микроскопом полученный препарат.
| Цвет кристаллов: белый.
Форма кристаллов: игольчатая, в виде «снежинок».
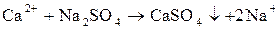
|
| Пирохими-ческий | 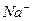
| Петлю из нихромовой проволоки промыть дистиллированной водой и прокалить в пламени газовой горелки. Захватить влажной петлёй кристаллик соли и внести его в среднюю горячую часть пламени. Наблюдать появление окраски. | Цвет пламени: интенсивно желтый. |

| Цвет пламени: сиреневый (лиловый) слабый. | ||

| Цвет пламени: ярко-красный. | ||

| Цвет пламени: бледно-зеленый. | ||

| Цвет пламени: окрашивания не наблюдается, искрится. | ||
| Способ проведе-ния реакции | Опреде-ляемый ион | Порядок выполнения | Аналитический признак, уравнение реакции |
| Пробир-ный | 
| 1 мл раствора  отобрать в пробирку, добавить туда 4–5 к. отобрать в пробирку, добавить туда 4–5 к.  и раствор осторожно нагреть на пламени горелки до кипения. Универсальным индикатором определить и раствор осторожно нагреть на пламени горелки до кипения. Универсальным индикатором определить  выделившегося газа. выделившегося газа.
| Выделение бесцветного газа с характерным запахом аммиака.
Цвет индикатора: синий.
Значение  > 8. > 8.

|
Приложение № 2
Таблица – Качественные реакции катионов в растворах индивидуальных солей
| Определяемый ион, (цвет раствора) | Условия проведения | Реагент | Аналитический признак, уравнение реакции |
 (бесцветный.)
(бесцветный.)
| Среда щелочная: 5-6 к. 
| Реактив Неслера
( 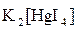 ) )
| Выпадение мелкокристаллического осадка кирпичного (красновато-оранжевого) цвета.

|
 (бесцветный).
(бесцветный).
| Среда щелочная:
2-3 капли  и и 
| 
| Выпадение мелкокристаллического осадка белого цвета.
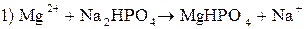 ; ;
 суммарная реакция:
суммарная реакция:

|
 (бесцветный)
(бесцветный)
| Среда кислая: 3-4 к. 
| 
| Выпадение мелкокристаллического осадка светло-желтого цвета.

|
| Определяемый ион, цвет соли | Условия проведения | Реагент | Аналитический признак, уравнение реакции |
 (желтый).
(желтый).
| Среда нейтральная | 
| Выпадение аморфного студенистого осадка синего цвета (турнбулева синь).

|
 (оранжевый). (оранжевый).
| Среда кислая: 1-2 капли 
| 
| Выпадение аморфного студенистого осадка темно-синего цвета (берлинская лазурь).
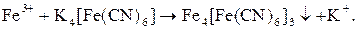
|
 (бесцветный)
(бесцветный)
| Внести 2-3 к. 2н раствора  (среда) и 1-2 к. ализарина (реагент). Пробирку нагреть. После охлаждения внести по каплям (среда) и 1-2 к. ализарина (реагент). Пробирку нагреть. После охлаждения внести по каплям  (до полного изменения окраски раствора). (до полного изменения окраски раствора).
| ализарин | .
Цвет раствора до добавления 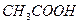 - фиолетовый или красный, а по мере добавления - фиолетовый или красный, а по мере добавления 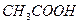 переходит в желто-оранжевый (морковный). переходит в желто-оранжевый (морковный).
|
 (розовый)
(розовый)
| Среда кислая: 4-5 капель 
| Реактив Ильинского | Выпадение аморфного хлопьевидного осадка красного цвета.

|
| Определяемый ион, цвет соли | Условия проведения | Реагент | Аналитический признак, уравнение реакции |
 (темно синий)
(темно синий)
| Среда щелочная: 2-3 к.  , пробирку осторожно нагреть. Затем прибавлять , пробирку осторожно нагреть. Затем прибавлять  до образования характерной окраски до образования характерной окраски
| 
| При нагревании зеленый цвет раствора гидроксида хрома меняется на желтый, а образовавшийся осадок исчезает.
 ; ;

|
 (светло-зеленый)
(светло-зеленый)
| Среда щелочная: 2-3 к. 
| Реактив Чугаева | Образование аморфного студенистого осадка малинового цвета: (  ). ).
|
 (бесцветный)
(бесцветный)
| Среда нейтральная; пробирку нагреть | 
| Образование аморфного студенистого осадка светло-желтого цвета.
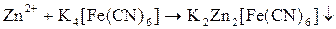
|
 (сине-зеленый)
(сине-зеленый)
| среда нейтральная | 
| Выпадение аморфного студенистого осадка бурого (красно-коричневого) цвета.

|
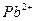 (бесцветный)
(бесцветный)
| среда нейтральная | 
| Выпадение мелкокристаллического осадка ярко-желтого цвета.

|
Приложение № 3
Таблица – Качественные реакции анионов в растворах индивидуальных солей
| Определя-емый ион, | Условия проведения | Реагент | Аналитический признак, уравнение реакции |

| Реакция с групп-повым реагентом (малоселективная) выполняется в кислой (1 – 2 кап.  ) или нейтральной среде ) или нейтральной среде
| 
|  – образование аморфного творожистого осадка белого цвета. – образование аморфного творожистого осадка белого цвета.

|

|  – образование аморфного творожистого осадка бледно-желтого цвета. – образование аморфного творожистого осадка бледно-желтого цвета.

| ||

|  – образование аморфного творожистого осадка светло-желтого цвета. – образование аморфного творожистого осадка светло-желтого цвета.
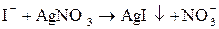 . .
| ||

| Среда нейтральная |  или или 
| Выпадение мелко кристаллического осадка желтого цвета.

|
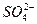
| Среда нейтральная | 
| Выпадение мелкокристаллического осадка белого цвета.
 . .
|
 (добавить в последнюю очередь)
(добавить в последнюю очередь)
| Среда кислая: 4-5 капель 
|  раствор ярко-фиолетового цвета.
раствор ярко-фиолетового цвета.
| Происходит обесцвечивание раствора 
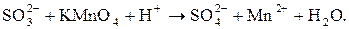
|
| Определя-емый ион, | Условия проведения | Реагент | Аналитический признак, уравнение реакции |

| Среда нейтральная | 
| Реагент  красного цвета. Образовался аморфный осадок белого цвета. красного цвета. Образовался аморфный осадок белого цвета.
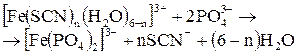
|
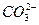
| Среда кислая – создаётся реагентом, пробирку нагреть | 
| Выделение бесцветного газа, без запаха с
рН  5. 5.
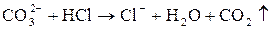
|

| Среда кислая:
2-3 капли 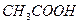
|  (кристаллический) (кристаллический)
| Раствор окрашивается в коричневый цвет, наблюдается выделение газа. |

| Среда: щелочная – 1 – 2 кап. 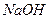 , пробирку осторожно нагреть до выделения газа , пробирку осторожно нагреть до выделения газа
| порошок
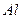 или или 
| Выделение бесцветного газа с характерным запахом аммиака.
Цвет индикатора: синий.
Значение   10. 10.
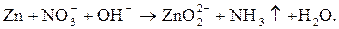
|
|
из
5.00
|
Обсуждение в статье: Пропись качестве6нных реакций катионов и анионов в растворах индивидуальных солей |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |
Популярное:
Как выбрать специалиста по управлению гостиницей: Понятно, что управление гостиницей невозможно без специальных знаний. Соответственно, важна квалификация...
Генезис конфликтологии как науки в древней Греции: Для уяснения предыстории конфликтологии существенное значение имеет обращение к античной...
Почему человек чувствует себя несчастным?: Для начала определим, что такое несчастье. Несчастьем мы будем считать психологическое состояние...

©2015-2024 megaobuchalka.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. (729)
Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

