 |
Главная |
Теплоты сгорания и энергии напряжения циклоалканов
|
из
5.00
|
| Размер цикла | Теплота сгорания на группу СН2, кДж/моль | Энергия напряже-ния на группу СН2, кДж/моль | Отклонение от угла 109о28¢ при плоском расположении атомов | Вид напряжения |
| Малые | 697,1 685,9 | 38,5 27,3 | 24о44¢ 9о44¢ | Угловое напряжение |
| Нормальные | 664,0 659,0 662,3 | 5,4 0,0 3,7 | 0о44¢ -5о16¢ -9о33¢ | Угловое напряжение (невелико) и торсионное напряжение (невелико) |
| Средние | 663,8 664,4 663,6 662,8 | 5,2 5,8 5,0 4,2 | -12о46¢ -15о16¢ -17о16¢ -18о54¢ | Угловое и торсионное напряжение, трансанулярные взаимодействия* |
| Большие | 659,8 660,2 658,6 | 1,2 1,6 0,0 | -20о16¢ -21о25¢ -22о25¢ | Напряжение отсутствует, сравнимы с н-алканами с длинными цепями |
*Трансанулярное взаимодействие – отталкивание ковалентно несвязанных атомов, расположенных на противоположных сторонах цикла.
Что же неверно в теории Байера? Только одно: Байер считал, что кольцо является плоским, но только трехчленный цикл должен быть плоским. Циклы, содержащие большее число атомов углерода, не обладают плоской конфигурацией.
Что же означает угловое напряжение с позиций современной теории? Для образования связей необходимо такое расположение атомов, при котором орбитали одного атома перекрывались бы с орбиталями другого атома. Чем больше такое перекрывание, тем прочнее связь. Когда углерод связан с четырьмя другими одинаковыми атомами, его sp3-гибридные орбитали направлены к углам тетраэдра. Образование связи происходит в результате перекрывания его sp3-орбитали с аналогичной sp3-орбиталью другого атома. Такое перекрывание наиболее эффективно и связь наиболее прочна, если два атома расположены так, что оси этих sp3-гибридных орбиталей лежат на прямой, соединяющей ядра атомов. В этом случае угол между углерод-углеродными связями С-С-С должен составлять 109о28¢ (рис. 3.1).

Рис. 3.1. Молекула алкана. Оси sp3-гибридных облаков лежат на линии, соединяющей ядра атомов
В циклопропане угол между углерод-углеродными связями С-С-С равен 60о. Атомы углерода не могут располагаться так, чтобы позволить sp3-орбиталям быть направленными друг к другу. В этом случае перекрывание sp3-орбиталей меньше, связь слабее, чем в случае обычной С-С-связи ациклического соединения (рис. 3.2).

Рис. 3.2. Молекула циклопропана. Оси sp3-гибридных облаков лежат вне линий, соединяющих ядра атомов («банановая» связь)
Конформации циклобутана.Циклобутан - слегка изогнутая молекула, но поскольку степень изогнутости молекулы циклобутана мала, а барьер перехода от одной конформации к другой низок, то производные циклобутана можно считать практически плоскими.

Конформации циклопентана. Молекула циклопентана изогнута (форма конверта). Эта изогнутость может перемещаться по кольцу в результате движения одного атома вверх, а соседнего с ним атома – вниз. Каждый атом в молекуле совершает такие последовательные движения, которые в целом можно представить как вращение кольца вокруг верикальной оси. Этот процесс называется псевдовращение.

Конформации циклогексана.Циклогексан в противоположность другим циклоалканам с размером цикла до С12 существует в виде почти ненапряженных конформеров. Наиболее стабильной является форма кресла. В этом конформере все углы между связями равны тетраэдрическим (109°28¢), следствием чего является отсутствие угловогонапряжения.
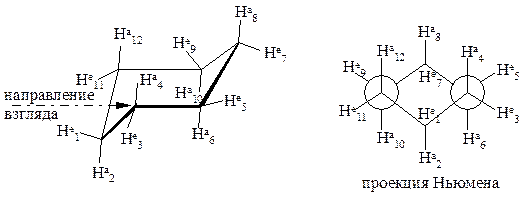
Если посмотреть вдоль любой из углерод-углеродных связей, то в каждом случае имеется идеальная заторможенная конформация, это означает, что конформация кресла свободна и от торсионногонапряжения.
В молекуле циклогексана в форме кресла двенадцать связей С -Н различают по положению в пространстве: шесть аксиальныхсвязей (символ “а”) направлены параллельно главной оси попеременно вверх и вниз. Другие шесть связей направлены к “экватору” молекулы и так же - вверх и вниз, их называют экваториальными (символ “е”).
Кроме формы кресла, существуют также формы полукресла, ванны и твист-форма циклогексана. Все эти конформации относительно легко могут претерпевать последовательные взаимопревращения (рис. 3.3).

Рис. 3.3. Конформации циклогексана
В монозамещенном циклогексане группа G может занимать аксиальное или экваториальное положение. Аксиальный конформер из-за отталкивания между заместителями у атома С1 и у атомов С3 и С5 (напряжение Ван-дер-Ваальса) богаче энергией, чем экваториальная форма. Различие в энергиях таких форм зависит от характера заместителя.

Так, экваториальная конформация метилциклогексана более устойчива, чем аксиальная, различие в энергии составляет 7,1 кДж/моль. При температуре 25 оС 95 % молекул метилциклогексана находится в экваториальной конформации и лишь 5 % - в аксиальной.
Химические свойства
Химические свойства циклоалканов во многом совпадают со свойствами алканов. Для них характерны прежде всего реакции радикального замещения.
Помимо реакций свободнорадикального замещения, характерных для циклоалканов, циклопропан и циклобутан вступают в некоторые реакции присоединения с раскрытием кольца.
Гидрирование. Циклопропан реагирует с водородом в присутствии катализатора (Ni, T = 80 оС) с разрывом кольца.

Циклобутан также взаимодействует с разрывом цикла, но при более высокой температуре 200 оС.

Пятичленный цикл разрывается только при значительно более высокой температуре 300 оС.

Циклогексан в этих условиях дегидрируется, кольцо сохраняется.

Галогенирование. Реакция с бромом также идет по-разному в зависимости от размера цикла.

Циклобутан не взаимодействует с бромом подобным образом.

Циклопентан и циклогексан реагируют с галогенами (Cl2, Br2) по механизму радикального замещения.

Гидрогалогенирование. Циклопропан взаимодействует с иодоводородом, как ненасыщенное соединение - присоединяет галогеноводород, при этом происходит раскрытие цикла.

Остальные циклопарафины с галогеноводородами не реагируют.
В реакциях циклоалканов проявляется различие в свойствах малых циклов и пяти-, шестичленных циклов. Циклопропан, а также циклобутан (в меньшей степени) вступают в реакции присоединения, проявляя свойства ненасыщенных соединений.
Способы получения
|
из
5.00
|
Обсуждение в статье: Теплоты сгорания и энергии напряжения циклоалканов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

