 |
Главная |
Теплота гидрирования и устойчивость алкенов
|
из
5.00
|
Теплоты гидрирования дают информацию об относительной устойчивости алкенов. Для сравнения устойчивости алкенов нужно сопоставить теплоты гидрирования различных алкенов для одного и того же алкана в равных условиях.
Например, сравним теплоты гидрирования 1-бутена, цис-2-бутена и транс-2-бутена. В реакциях поглощается 1 моль водорода и образуется один и тот же продукт – н-бутан.
При гидрировании транс-изомера выделяется на 4 кДж/моль энергии меньше, чем при гидрировании цис-изомера. Это означает, что содержание энергии в нем на 4 кДж/моль меньше, т.е. другими словами, транс-изомер на 4 кДж/моль устойчивее цис-изомера. В транс-изомере два объёмистых заместителя расположены по разные стороны от двойной связи, пространственные препятствия меньше, чем в случае цис-изомера. В свою очередь, оба геометрических изомера 2-бутена более устойчивы, чем 1-бутен (рис. 4.7).

Рис. 4.7. Теплоты гидрирования изомеров бутена
Сравним теплоты гидрирования (кДж/моль) алкенов, которые при взаимодействии с водородом дают 2-метилбутан.
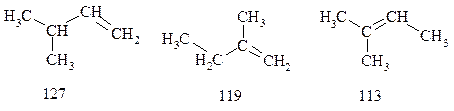
Различие в теплотах гидрирования обусловлено их различной устойчивостью.
| Чем больше степень алкилирования атомов углерода при двойной связи, тем более устойчив алкен: |

|
Различная устойчивость алкенов может быть объяснена неодинаковой возможностью распределения электронной плотности в молекулах с различным числом метильных групп при углеродах у двойной связи. Электроны s-связи углерод – водород метильной группы частично перекрываются с электронами p-связи (гиперконъюгация). Такое электронное взаимодействие ведет к уменьшению энергии молекулы.
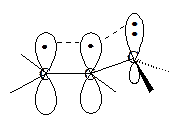
К объяснению изменения устойчивости алкенов в приведенном ряду также может быть привлечено представление о различии энергий и длин связей, образованных sp3- и sp2-гибридизованными атомами углерода.
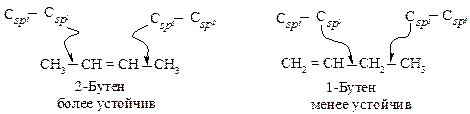
В 2-бутене имеются две более короткие и более прочные s-связи Сsp3–Сsp2, а в 1-бутене – только одна такая связь.
Присоединение галогенов
Алкены реагируют с бромом и хлором в инертном растворителе (например, в четыреххлористом углероде), образуя вицинальные дигалогениды (vicinalis - соседний).
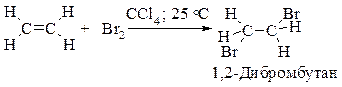
Этот процесс протекает как электрофильное присоединение.
Механизм реакции
Первая стадия. Неполярная молекула галогена поляризуется под действием богатой электронами двойной углерод-углеродной связи. Изменение распределения электронной плотности в одной молекуле под влиянием внешних условий (растворитель, другие молекулы, ионы) называется поляризацией. Поляризованная таким образом молекула галогена взаимодействует с p-cистемой, образуя p-комплекс:
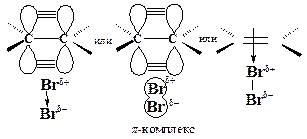
Вторая стадия. p-Комплекс разрушается, ион брома ВrÅ- электрофил - присоединяется к атому углерода и образуется s-комплекс - карбокатион. Вторая стадия - медленная, определяет скорость всего процесса.

Положительно заряженный атом углерода находится в sр2-гибридизованном состоянии (его 2р-орбиталь не занята). Свободная 2р-орбиталь перекрывается с неподеленной парой электронов атома брома, образуя циклический ион бромония.
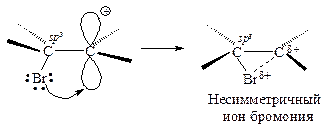
Третья стадия. Оставшийся анион брома (нуклеофил - ядро любящий) атакует образовавшийся циклический ион бромония по второму атому углерода.
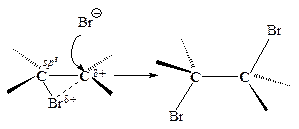
Энергетическая диаграмма бромирования этилена приведена на рис. 4.8.

Рис. 4.8. Энергетическая диаграмма реакции бромирования этена
Стадия 2 – медленная, с высокой энергией активации
Доказательствами справедливости этого механизма служат следующие факты:
1). При проведении бромирования в растворе, содержащем помимо аниона брома другой нуклеофил (например, анион хлора), в продуктах реакции появляется наряду с дибромидом соединение, содержащее хлор.

2). В соответствии со стадией 3 (рис. 4.8) электрофил - катион брома и нуклеофил - анион брома должны присоединяться к aлкeнy с противоположных сторон, т.е. в транс-положение.
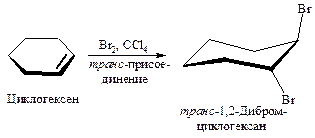
Присоединение брома к циклогексену действительно происходит в транс-положение.
4.4.3.2. Реакционная способность галогенов в реакции АdЕ
Присоединение хлора и брома к алкенам происходит легко и во многих случаях с количественным выходом. Присоединение йода к алкенам осуществить не удается. Взаимодействие фтора с алкенами происходит так энергично, что углеводород распадается на осколки с меньшим числом атомов углерода.
|
из
5.00
|
Обсуждение в статье: Теплота гидрирования и устойчивость алкенов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

