 |
Главная |
Внутримолекулярная реакция Вюрца дигалогеналканов
|
из
5.00
|

Эта реакция пригодна для получения циклоалканов с n от 3до 6.
Пиролиз солей дикарбоновых кислот
С помощью пиролиза кальциевых и бариевых солей дикарбоновых кислот могут быть получены циклические соединения с n = 5, 6, 7.

Диеновый синтез

Гидрирование ароматических углеводородов

АЛКЕНЫ
Углевороды с открытой цепью, содержащие одну двойную связь, имеют общую формулу СnH2n и называются алкенами.
Изомерия алкенов
Для алкенов характерна структурная изомерия, связанная с изменением углеродного скелета и изменением положения двойной связи. Другой вид изомерии - пространственная изомерия - определяется расположением заместителей относительно плоскости двойной связи. Бутены имеют общую эмпирическую формулу С4Н8. Этой формуле соответствуют следующие соединения:

1-Бутен, метилпропен и каждый из 2-бутенов различаются способом соединения атомов и являются структурными изомерами. Цис- и транс-2-бутены имеют одинаковый способ связывания атомов, поэтому не являются структурными изомерами. Однако из-за различного пространственного расположения метильных радикалов при углеродах с двойной связью это разные вещества. Они представляют собой пространственные изомеры – стереоизомеры. Эти стереоизомеры не являются энантиомерами, их называют диастереомерами (см. п. 2.5). Диастереомеры, возникающие в результате затрудненного вращения одного атома углерода относительно другого вследствие наличия p-связи между ними, называют p-диастереомерами или геометрическимиизомерами.
О заместителях, расположенных по одну сторону от плоскости двойной связи, говорят, что они находятся в цис-положении относительно друг друга; если они расположены по разные стороны от плоскости двойной связи, то это транс-положение

Этот простой способ обозначения пространственного расположения групп неприменим ко многим три- и тетра-замещенным алкенам.
Для названия таких соединений была создана Е,Z-номенклатура. Правила Е,Z-номенклатуры следующие:
1. Используя систему Кана-Прелога-Ингольда (п. 2.4), определяют относительное старшинство заместителей при атомах углерода с двойной связью и дают им номера по старшинству (1) и (2).
2. Если две старшие группы расположены по одну сторону от плоскости p-связи, то конфигурация соединения обозначается символом Z (zusammen - вместе), если же эти группы находятся по разные стороны от плоскости p-связи, то конфигурацию обозначают символом Е (Entgegen - напротив).


4.2. Строение этена
Простейший представитель алкенов – этен (этилен) СН2=СН2. Атомы углерода в молекуле этена находятся в sp2-гибридном состоянии. Изобразим подробную орбитальную конфигурацию этилена на рис. 4.1.

Рис. 4.1. Направления и формы орбиталей sp2-гибридизованного атома углерода:
Гибридизованные орбитали (1) эквивалентны, (2) - имеют большую направленность в пространстве, (3) - максимально удалены друг от друга, атом углерода в состоянии sp2-гибридизации называется тригональным атомом углерода.
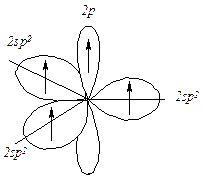
В результате гибридизации одной 2s-орбитали и двух 2р-орбиталей (из трех) образуются три эквивалентные гибридизованные sp2-орбитали и остается одна негибридизованная 2р-орбиталь. Гибридизованные орбитали имеют гораздо большую направленность, чем 2s- или 2р-орбиталь. Вследствие большего перекрывания с орбиталями других атомов эти гибридные орбитали образуют более прочные связи. sp2-Гибридизованные орбитали расположены в одной плоскости и направлены к углам правильного треугольника, угол между осями sp2-гибридизованных орбиталей составляет 120º. При таком тригональном расположении гибридные орбитали максимально удалены друг от друга.

| 
|
Рис. 4.2. Схема формирования sp2-гибридизованных орбиталей атома углерода
Если мы соединим два sp2-гибридных атома углерода, то получим две углерод-углеродные связи: одну s-связь, образованную перекрыванием двух sp2-орбиталей, и одну p-связь, образованную перекрыванием двух 2р-орбиталей. Построение молекулы этена заканчиваем добавлением атомов водорода, валентные электроны которых (1s) взаимодействуют с оставшимися sp2-гибридными орбиталями углеродных атомов.

|

|
Рис. 4.3. Молекула этена:
а - боковое перекрывание 2р-орбиталей (p-перекрывание);
б - p-связь состоит из двух электронных облаков, одно из которых лежит над, а другое – под плоскостью молекулы
Таким образом, двойная углерод-углеродная связь построена из более прочной s-связи (347 кДж/моль) и менее прочной p-связи (260 кДж/моль). p-Связь делает невозможным вращение одного атома углерода относительно другого вдоль связи углерод-углерод. С этим связано явление геометрической изомерии.
Двойная углерод-углеродная связь в этене короче, чем простая связь в этане.

Рис. 4.4. Геометрические параметры молекулы этена
Спектральные исследования показали, что расстояние С–Н в этилене равно 10,9·10-2 нм, что несколько меньше, чем расстояние С–Н в этане (11,02·10-2 нм). Для объяснения такого различия необходимо принять во внимание, что гибридизация атомов углерода в этих соединениях неодинакова. Связь углерод-водород в этене образована в результате перекрывания 1s-орбитали водорода с sp2- , а не sp3-гибридной орбиталью углерода, как в этане. По сравнению с sp3- орбиталью sp2-орбиталь имеет меньшую долю p-орбитали и большую долю s-орбитали. p-Орбиталь находится на большем расстоянии от ядра, чем s-орбиталь. По мере возрастания s-характера гибридной орбитали её эффективный размер уменьшается и одновременно уменьшается длина связи с другим атомом. Поэтому связь водорода с sp2-гибридизованным атомом углерода (sp2-1s) должна быть короче, чем с sp3-гибридизованным (sp3-1s).
Более короткие связи будут более прочными; энергия диссоциации связи С—Н в этилене (435 кДж/моль) больше, чем в этане (405 кДж/моль). Рассмотрение гибридизации и размеров орбиталей позволяет предположить, что sp2- sp3 -связь должна быть короче, чем sp3 - sp3-связь. Сравните:

Рассмотрение гибридизации и размеров орбиталей помогает объяснить некоторые свойства молекул, например, относительную кислотность углеводородов. Чем больше доля s-состояния в гибридной орбитали атома углерода, тем более электроотрицательным он будет. Электроотрицательность атомов углерода уменьшается в следующем порядке:
Сsp > Сsp2 > Сsp3
Общая электронная пара связи С–Н частично смещена к углероду даже в алкане с sp3-гибридными орбиталями углерода, дипольный момент связи равен 0,3 D. В алкене электронная пара связи =С–Н должна быть ещё больше сдвинута к ядру атома углерода вследствие sp2-гибридного состояния его орбиталей. Поэтому =С–Н связь в этилене более полярна, чем в алканах, с большим положительным зарядом на атоме водорода; дипольный момент связи =С–Н равен 0,6 D.
sp2-Гибридизованный атом углерода может образовывать двойную связь с любым элементом, способным существовать с частично заполненными p- и sp2-орбиталями. Например, кислород предоставляет необходимые для такой связи орбитали путём следующей гибридизации:

Простейшим промером такого состояния кислорода является формальдегид Н2С=О:
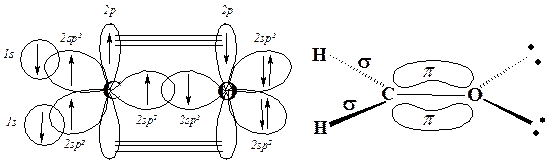
Физические свойства
Физические свойства алкенов в основном сходны с соответствующими свойствами алканов. Алкены нерастворимы в воде, но хорошо растворимы в неполярных растворителях, таких как бензол, тетрахлорметан. Их плотность меньше плотности воды. Так же как и в случае алканов, температуры кипения повышаются на 20 - 30 оС при увеличении длины цепи на один атом углерода (за исключением низших алкенов). Разветвление углеродной цепи в молекулах изомеров понижает температуру кипения (табл. 4.1).
Таблица 4.1
|
из
5.00
|
Обсуждение в статье: Внутримолекулярная реакция Вюрца дигалогеналканов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

