 |
Главная |
Кислородосодержащие кислоты фосфора
|
из
5.00
|
Фосфорновативтая кислота Н3РО2
При получении РН3 нагреванием белого фосфора с раствором щелочи в качестве второго продукта образуется бариевая соль фосфорноватистой кислоты (гипофосфит), :
Рбел. + Ва(ОН)2 + Н2О → РН3 + Ва(Н2РО2)2.
Действием на эту соль серной кислотой может быть получена свободная фосфорноватистая кислота (Н3РО2).
Несмотря на наличие в её молекуле трёх атомов водорода, она только одноосновная (и является довольно сильной), что согласуется со структурной формулой:
Н
½
Н—О—Р—Н
||
О
Соли хорошо растворимы в воде. Гипофосфит бария легко очищается перекристаллизацией. После его обменного разложения с Н2SO4 из сгущённого и охлаждённого фильтрата (от ВаSO4) фосфорноватистая кислота выделяется в виде больших кристаллов, плавящихся при 27 °С (и при дальнейшем нагревании разлагающихся).
Она может быть получена взаимодействием РН3 с водной суспензией йода по схеме:
I2 + Н2О + РН3 → НI + H3PO2.
В растворе Н3PO2 проявляет тенденцию к распаду с выделением водорода и образованием Н3PO3 и H3PO4, но распад этот без катализаторов (Pd и т. п.) становится практически заметным лишь при высоких температурах или в сильнощелочной среде.
При нагревании Н3РО2 диспропорционирует:
Н3РО2 t→ Н3РО3 + РН3.
В сильнокислой среде (особенно при нагревании) фосфорноватистая кислота и её соли являются очень энергичными восстановителями. Например, соли ртути она восстанавливает до металла:
HgCl2 + H3PO2 + H2O → H3PO3 + Hg + 2 HСl.
Эта способность – восстанавливать растворы некоторых солей (никеля, меди и др.) до свободного металла нашла широкое применение в промышленности.
Напротив, в разбавленных растворах на холоду Н3РО2 не окисляется ни кислородом воздуха, ни свободным йодом.
Фосфористая кислота Н3РО3
Свободная фосфористая кислота (Н3РО3) представляет собой бесцветные кристаллы, расплывающиеся на воздухе и легкорастворимые в воде. Она является сильным (но в большинстве случаев медленно действующим) восстановителем. Несмотря на наличие в молекуле трёх водородов, Н3РО3 функционирует только как двухосновная кислота средней силы. Соли её (фосфористокислые или фосфиты), как правило, бесцветны и труднорастворимы в воде (растворимы только соли щелочных металлов). Строение фосфористой кислоты:

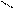 Н – О Н
Н – О Н


 Р
Р
Н – О О
При нагревании безводной кислоты или её концентрированных растворов происходит диспропорционирование по схеме:
Н3РО3 = РН3 + Н3РО4.
Кислородом воздуха растворы фосфористой кислоты при обычных условиях заметно окисляются только в присутствии следов иода, а чистая (не содержащая оксидов азота) азотная кислота не окисляет её даже при кипячении.
Фосфористая кислота и фосфиты сильные восстановители, восстанавливают неактивные металлы (Hg, Ag).
Взаимодействие фосфористой кислоты с хлоридом ртути (II) медленно идёт по уравнению:
Н3РО3 + HgCl2 + H2O → H3PO4 + Hg + HCl
Н3РО3 + AgNO3 + H2O → H3PO4 + Ag + HNO3
Для фосфористой кислоты известны не только средние, но и кислые соли. Примерами тех и других могут служить Na2HPO3·5H2O и NaH2PO3·2,5H2O. Получены также некоторые комплексные производные Н3РО3, например, зелёная кислота Н3[Cr(HPO3)3]·10H2O и некоторые её соли. При прокаливании фосфидов происходит распад их на соответствующие фосфаты и производные низших степеней окисления фосфора, вплоть до РН3.
Ортофосфорная кислота Н3РO4
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4 (часто эту кислоту называют просто фосфорной).
Фосфорная кислота представляет собой белое твердое вещество, хорошо растворимое в воде. В отличие от азотной кислоты не является окислителем и не разлагается при нагревании, что объясняется наибольшей устойчивостью степени окисления +5 из всех возможных для фосфора. Фосфорную кислоту получают следующим образом:
Взаимодействием оксида или хлорида фосфора с водой:
PCl5 + H2O → H3PO4 + HCl.
Действием серной кислоты на фосфаты:
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4.
Или при окислении белого фосфора концентрированной азотной кислотой:
Pбел. + HNO3конц. + H2O → H3PO4 + NO.
Фосфорная кислота – трёхосновная:

В водном растворе фосфорная кислота диссоциирует ступенчато. Как трехосновная кислота, Н3Р04 образует три типа солей: дигидрофосфаты(замещен один атом водорода кислоты), например NaH2PO4; гидрофосфаты(замещены два атома водорода кислоты), например Na2HPO4; фосфаты(замещены все атомы водорода в фосфорной кислоте), например Na3PO4.
Все дигидрофосфаты растворимы в воде. Из гидрофосфатов и фосфатов в воде растворимы только соли щелочных металлов и аммония.
|
из
5.00
|
Обсуждение в статье: Кислородосодержащие кислоты фосфора |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

