 |
Главная |
Соединения с кислородом
|
из
5.00
|
Оксид углерода (II). При неполном окислении углерода образуется оксид углерода (II) СО — угарный газ. В воде он плохо растворим. Формальная степень окисления углерода 2+ не отражает строение молекулы СО. В молекуле СО, помимо двойной связи, образованной обобществлением электронов углерода и кислорода, имеется дополнительная, третья связь (изображена стрелкой), образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода:
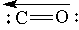
В связи с этим молекула СО крайне прочна. Оксид углерода (II) является несолеобразующим и не взаимодействует в обычных условиях с водой, кислотами и щелочами. При повышенных температурах он склонен к реакциям присоединения и окисления-восстановления. На воздухе СО горит синим пламенем:
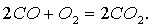
Он восстанавливает металлы из их оксидов:
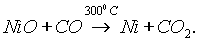
Под действием облучения на прямом солнечном свету или в присутствии катализаторов СО соединяется с Cl2, образуя фосген — крайне ядовитый газ:
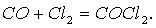
Фосген гидролизуется водой:
COCl2 + H2O → H2CO3 + HCl
CO окисляется серой при высоких температурах:
CO + S t→ COS
Образующийся тиооксид углерода (О=С=S) представляет собой бесцветный и не имеющий запаха газ. В воде он довольно хорошо растворим (1:2 по объёму) и постепенно гидролизуется по схеме:
СОS + H2O → CO2 + H2S.
В природе оксид углерода (II) практически не встречается.Он может образовываться при обезвоживании муравьиной кислоты (лабораторный способ получения):
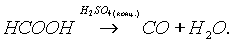
Исходя из последнего превращения чисто формально можно считать СО ангидридом, муравьиной кислоты. Это подтверждается следующей реакцией, которая происходит при пропускании СО в расплав щелочи при высоком давлении:
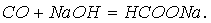
Н2С2О4 → СО + СО2 + Н2О в лаборатории при нагревании щавелевой кислоты, также можно получить СО.
СО восстановитель и в растворах. Легко идет в растворе восстановление хлористого палладия:
PdCl2 + H2O + CO → CO2 + 2 HCl + Pd
служит наиболее часто применяемой реакцией открытия монооксида углерода в смеси газов.
Монооксид углерода (II) способен непосредственно соединяться с некоторыми металлами. В результате образуются карбонилы металлов [Fe(CO)5, Ni(CO)4, Mo(CO)6 и др.], которые следует рассматривать как комплексные соединения. Все они весьма ядовиты, а при нагревании легко распадаются на соответствующий металл и оксид углерода(II).
Оксид углерода (IV) и угольная кислота.Оксид углерода (IV) бесцветный газ, хорошо растворимый в воде. Является кислотным оксидом угольной кислоты Н2СО3.
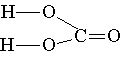
При растворении CO2 в воде частично образуется угольная кислота, при этом в растворе существует следующее равновесие:

Существование равновесия объясняется тем, что угольная кислота является очень слабой кислотой. В свободном виде угольная кислота неизвестна, так как она неустойчива и легко разлагается.
Будучи двухосновной кислотой, Н2СО3 даёт два ряда солей: средние (с анионом СО3-2) и кислые (с анионом НСО3-). Первые называются карбонатами, вторые гидрокарбонатами или бикарбонатами. Подобно самим анионам угольной кислоты, большинство её солей бесцветно.
Из карбонатов наиболее обычных катионов растворимы только соли Na, K и NH4. В результате значительного гидролиза их растворы имеют щелочную реакцию (Вспомнить гидролиз карбонатов).
Карбонаты натрия и калия плавятся без разложения, а большинство остальных карбонатов при прокаливании разлагаются на углекислый газ и оксид соответствующего металла:
CaCO3 t→ CaO + CO2
Ca(HCO3)2 t→ CaO + CO2 + H2O
Под действием сильных кислот все карбонаты легко разлагаются с образованием соли сильной кислоты, воды и углекислого газа:
MgCO3 + HCl → MgCl2 + CO2 + H2O
Mg(HCO3)2 + HCl → MgCl2 + CO2 + H2O
Из солей угольной кислоты наибольшее практическое значение имеет сода Na2СО3. Эта соль образует несколько кристаллогидратов, из которых самым устойчивым является Na2СО3∙10H2O (кристаллическая сода). При прокаливании кристаллической соды получают безводную, или кальцинированную, соду Na2СО3. Широко используется также питьевая сода NaHСО3. Из солей других металлов важное значение имеют: K2СО3 (поташ) – белый порошок, хорошо растворимый в воде, содержится в золе растений, применяется в производстве жидкого мыла, оптического тугоплавкого стекла, пигментов; CaСО3 (известняк) – встречается в природе в виде мрамора, мела и известняка, которые применяют в строительном деле, из него получают известь и оксид углерода (IV).
Сероуглерод СS2 -при нормальных условиях жидкость, хороший растворитель органических веществ, фосфора, серы, йода.
В технике сероуглерод (СS2) получают пропусканием паров серы сквозь слой раскалённого угля, реакция эндотермическая:
С + 2 S + 88 кДж → СS2.
Чистый сероуглерод представляет собой весьма летучую бесцветную жидкость с довольно приятным запахом, но обычно он содержит незначительные примеси продуктов частичного разложения, сообщающие ему жёлтый цвет и отвратительный запах.
В воде сероуглерод почти нерастворим и при обычных условиях с ней не взаимодействует. Пары его ядовиты и очень легко воспламеняются. Сгорание их идёт по уравнению:
СS2 + 3 O2 → CO2 + 2 SO2 + 1100 кДж.
Сероуглерод является прекрасным растворителем жиров, масел, смол и т. п. На этом основано его применение для экстрагирования (извлечения) подобных веществ из различных природных материалов. Он имеет большое значение для промышленности искусственных волокон и используется также для борьбы с вредителями сельского хозяйства.
Молекула S=C=S линейна, d(C=S) = 156 пм и энергия 535 кДж/моль.
Подобно СО2, сероуглерод является кислотным ангидридом и с некоторыми сульфидами может образовывать соли тиоугольной кислоты (Н2СS3). Так, при взаимодействии СS2 с крепким раствором Na2S образуется Na2CS3. Тиокарбонаты наиболее активных металлов (а также NH4+) устойчивы, тогда как производные остальных более или менее легко разлагаются. В твёрдом виде большинство солей Н2СS3 жёлтого цвета, а растворы их обычно имеют красную окраску. Хорошо растворимы в воде лишь немногие тиокарбонаты, в частности, производные Na, K и NH4. Тиокарбонат калия применяется для борьбы с вредителями сельского хозяйства (главным образом с филлоксерой).
Свободная тиоугольная кислота может быть получена действием сильных кислот на крепкие растворы её солей: в начале происходит переход от красного цвета к жёлтому, а затем в виде маслянистой жидкости частично выделяется тиоугольная кислота (т. пл. -27 °С). Она постепенно разлагается водой на H2CO3 и Н2S, но всё же она несравненно устойчивее угольной кислоты. Её кислотные свойства также выражены гораздо более сильно.
HCl + K2CS3 → H2CS3 + KCl
Синильная кислота и её соли – цианиды.Цианистый водород (НСN) – бесцветная жидкость со слабым своеобразным запахом и вкусом (горького миндаля), благодаря водородной связи с водой смешивается в любых соотношениях, образуя цианистоводородную (синильную) кислоту. Её кислотные свойства выражены крайне слабо, и поэтому она легко выделяется из своих солей (цианидов) действием более сильных кислот.
Он может быть получен из СО и аммиака при нагревании и наличии катализатора ThO2:
СО + NH3 + 46 кДж → Н2О + НСN
Синильная кислота и её соли чрезвычайно ядовиты. Подобно самому иону СN-, большинство цианидов бесцветно. Производные наиболее активных металлов хорошо растворимы в воде, а менее активных, как правило, малорастворимы.
Цианистый водород может быть получен при 900°С по уравнению:
2 СН4 + 2 NH3 + 3 O2 = 6 H2O + 2 HCN + 961 кДж
путём пропускания газовой смеси сквозь контактный аппарат с платиновыми сетками. Для лабораторного получения чистой водной НСN (т. пл. -13, т. кип. +26 °С) лучше всего воспользоваться нагреванием растёртой в порошок смеси сухих КСN и КНS. Молекулы цианистого водорода обнаружены в межзвёздной среде.
Обычная синильная кислота содержит смесь молекул Н–СºN (нормальная форма) и Н–NºC (изоформа). Обе формы способны легко переходить друг в друга (путём перескока протона).
Токсическое действие синильной кислоты (и цианидов) вызывается, скорее всего, изоформой (НNC) и сводится в основном к параличу дыхания. В организме синильная кислота довольно легко разрушается с образованием безвредных продуктов, поэтому при несмертельных её дозах после периода острого отравления быстро наступает полное выздоровление. Средством первой помощи при желудочных отравлениях НСN и её солями служит возможно более быстрое возбуждение рвоты.
Кремний
Нахождение в природе.Кремний после кислорода — самый распространенный элемент в земной коре. В отличие от углерода в свободном состоянии кремний в природе не встречается. Наиболее распространенными его соединениями являются оксид кремния (IV) SiO2 и соли кремниевых кислот — силикаты. Они образуют оболочку земной коры. Соединения кремния содержатся в организмах растений и животных.
Природные силикаты имеют сложный состав и строение. Вот состав некоторых природных силикатов: полевой шпат К2О ∙ Аl2O3∙ 6SiO2, асбест 3MgО∙ 2SiO2∙ 2H2O, cлюда К2О∙ 3Аl2O3 ∙ 6SiO2 ∙ 2H2O, каолинит 3Аl2O3∙ 2SiO2∙ 2H2O.
Силикаты, содержащие в своем составе также оксид алюминия, называются алюмосиликатами. Из названных выше силикатов алюмосиликатами являются полевой шпат, каолинит и слюда. В природе наиболее распространены именно алюмосиликаты, например полевые шпаты. Распространены также смеси различных силикатов. Так, горные породы — граниты и гнейсы — состоят из кристалликов кварца, полевого шпата и слюды.
Драгоценным камнем является топаз [Al(F,OH)]2SiO4, кристаллы которого могут обладать разнообразной окраской светлых оттенков и достигать иногда гигантских размеров (масса наибольшего равнялась 117 кг).
Физические свойства. Кристаллический кремний — вещество темно-серого цвета со стальным блеском. Структура кремния аналогична структуре алмаза. В его кристалле каждый атом окружен тетраэдрически четырьмя другими и связан с ними ковалентной связью, которая значительно слабее, чем между атомами углерода в алмазе. В кристалле кремния даже при обычных условиях часть ковалентных связей разрушается. Поэтому в нем имеются свободные электроны, которые обусловливают небольшую электрическую проводимость. При освещении и нагревании увеличивается число разрушаемых связей, а значит, увеличивается число свободных электронов и возрастает электрическая проводимость. Так следует объяснять полупроводниковые свойства кремния.
Кремний очень хрупок, относится к тугоплавким веществам.
Кремний состоит из трех стабильных изотопов: 2814Si (92,27%), 2914Si (4,68%) и 3014Si (3,05%).
Применение. Кремний используют в качестве полупроводника. Из него изготовляют, так называемые, солнечные батареи, превращающие световую энергию в электрическую (питание радиоустановок космических кораблей). Кремний используют в металлургии для получения кремнистых сталей, обладающих высокой жаростойкостью и кислотоупорностью.
Получение.В промышленности кремний получают восстановлением SiO2 коксом в электрических печах:
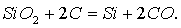
В лаборатории в качестве восстановителей используют магний или алюминий:


Наиболее чистый кремний получают восстановлением тетрахлорида кремния парами цинка:
SiCl4 + Znпар → Si + ZnCl2
Химические свойства.По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, так как он имеет больший атомный радиус. Поскольку у атомов кремния на внешнем энергетическом уровне находится 4 электрона, то для кремния характерна степень окисления как -4, так и +4 (известно соединение кремния, где его степень окисления равна +2).
Кремний при обычных условиях довольно инертен, что следует объяснить прочностью его кристаллической решетки. Непосредственно он взаимодействует только со фтором:

Галогениды кремния имеют общую формулу SiГ4 и могут быть получены прямым синтезом по схеме:
Si + 2 Г2 → SiГ4.
Фтор реагирует легко, остальные галогены — лишь при нагревании. Все галогениды SiГ4 бесцветны. При обычных условиях SiF4 газообразен, SiCl4 и SiBr4 представляют собой жидкости, SiI4 — твёрдое тело.
Из химических свойств галогенидов кремния наиболее характерно для них энергичное взаимодействие с водой по схеме:
SiГ4 + 2 Н2О Û SiO2 + 4 НГ.
Для Cl, Br и I равновесие практически нацело смещено вправо, тогда как для F реакция заметно обратима. Вследствие образования при гидролизе твёрдых частиц SiO2 (точнее, nSiO2•mH2O) пары галогенидов кремния дымят во влажном воздухе.
Из двух аллотропных модификаций кремния — кристаллической и аморфной — химически более активным является аморфный кремний. Он реагирует с кислородом при нагревании, образуя SiO2:
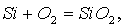
а также со всеми галогенами, например:

Si + N2 t→ Si3N4
При высокой температуре кремний соединяется с углеродом (t= 20000C), образуя карборунд SiC:

Карборунд имеет алмазоподобную кристаллическую решетку, в которой каждый атом кремния окружен четырьмя атомами углерода и наоборот, а ковалентные связи очень прочны, как в алмазе. Поэтому по твердости он близок к алмазу. Из карбида кремния изготовляют точильные камни и шлифовальные круги.
Кислоты (кроме смеси плавиковой HF и азотной HNO3) на кремний не действуют.
Si + HNO3 + HF → H2[SiF6] + NO + H2O
Однако он растворяется в гидроксидах щелочных металлов, образуя силикат и водород:
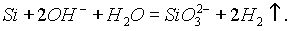
В реакциях с активными металлами, протекающих с образованием силицидов, кремний выступает в роли окислителя:

При высоких температурах кремний восстанавливает многие металлы из их оксидов.
|
из
5.00
|
Обсуждение в статье: Соединения с кислородом |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

