 |
Главная |
NO оксид монооксид азота (II)
|
из
5.00
|
В промышленности получают каталитическим окислением аммиака:
NH3 + O2 → NO + H2O смесь газов пропускают через платино-родиевую (Rh 5-10%) сетку, она служит катализатором.
Чистый NO можно получить в растворе:
NaNO2 + NaI + H2SO4 → NO + I2 + Na2SO4 + H2O
или при сплавлении:
KNO3 + KNO2 + Cr2O3 спл.→ K2CrO4 + NO.
Также образуется во многих реакциях восстановления азотной кислоты, растворов нитратов и нитритов.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
NO химически активен, при действии сильных восстановителей (SO2, Cr3+) легко восстанавливается до NH2OH или NH3, с водородом образует гремучую смесь, легко окисляется кислородом, галогенами и другими окислителями.
NO + O2 → NO2
NO2 оксид азота (IV)
Молекулы даже в парообразном состоянии частично димеризованы:
NO2 -11 C↔ +150 C N2O4
Жидкий и твёрдый NO2 - белого цвета, состоит из молекул N2O4.
В воде и растворах щелочей диспропорционирует:
NO2 + H2O → HNO3 + HNO2
NO2 + NaOH → NaNO3 + NaNO2 + H2O
NO2 химически активен, в нем горят C, S, P. При высокой температуре разлагается на NO и O2. В лаборатории получают действием на медь концентрированной азотной кислотой:
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
N2O3 оксид азота (III)
Существует в твёрдом состоянии, при низких температурах в жидком и газообразном состоянии значительно разлагается на NO и NO2.
Его получают взаимодействием NO и NO2.
Формально – это ангидрид азотистой кислоты, она неустойчива:
HNO2 → N2O3 + H2O
N2O3 → NO + NO2.
Её соли – нитриты хорошо растворимы в воде. Сама кислота и её соли могут быть и окислителями, восстанавливаясь до NO и восстановителями, окисляясь до нитратов.
KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
KI + KNO2 + H2SO4 → I2 + NO + K2SO4 + H2O
N2O5 оксид азота (V)
Получают дегидратацией азотной кислоты оксидом фосфора (V):
HNO3 + P2O5 → N2O5 + HPO3
Не очень устойчивый оксид, иногда взрывается, типичный кислотный оксид:
N2O5 + H2O → HNO3
N2O5 + NaOH → NaNO3 + H2O
Азотная кислота. НNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, очень гигроскопична, “дымит” на воздухе. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Химические свойства. Под действием света азотная кислота частично разлагается с выделением NО2 и за счет этого приобретает светло-бурый цвет:
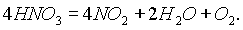
Азотная кислота принадлежит к числу наиболее сильных кислот, и для нее характерны все реакции, в которые вступают кислоты, — с основаниями, основными оксидами и т. д.
Получение. В промышленности получают в несколько стадий:
1стадия. Каталитическое окисление аммиака:

2 стадия. Окисление NO до NO2:
NO + O2 → NO2
3 стадия. Растворение NO2 в присутствии избытка кислорода:
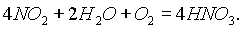
В лабораториидействием концентрированной серной кислотой на нитрат натрия (кристаллический):
NaNO3(кр.) + H2SO4 (конц.) → Na2SO4 + HNO3↑ Пар конденсируется в жидкое состояние.
Азотная кислота взаимодействует со всеми металлами, за исключением Au, Pt, W, Rh (родий), Ti, Ir (иридий). Концентрированная HNO3 не взаимодействует при обычных условиях также с Fe, Al и Сr, которые она пассивирует, однако при очень сильном нагревании HNO3 взаимодействует и с этими металлами.
Подукты восстановления азотной кислоты зависят от концентрации кислоты и активности восстановителя, чем более разбавленная кислота, тем в большей степени она восстанавливается.
С неактивными металлами:
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
С активными металлами:
Zn + HNO3(конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(очень разб.) → Zn(NO3)2 + NH4NO3 + H2O
Большинство неметаллов и сложных веществ восстанавливают HNO3, как правило, до NO (реже до NO2):
При окислении неметаллов образуются кислоты, как правило, в высшей степени окисления, а если кислота неустойчива, то образуются оксиды.
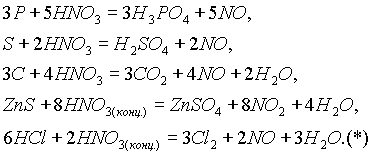
Азотная кислота окисляет при нагревании даже кремний:
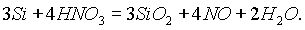
Однако полного растворения образца кремния при этом не происходит, так как, едва начавшись, последняя реакция быстро прекращается, поскольку образующийся на поверхности кристаллический SiO2 (кислотный оксид с высшей степенью окисления кремния) препятствует дальнейшему протеканию реакции.
С помощью концентрированной HNO3 можно растворить также и золото. Для этого необходимо взять смесь, состоящую из одного объема концентрированной HNO3 и трех объемов концентрированной соляной кислоты (такую смесь называют царской водкой):
Au + HNO3 + HCl → H[AuCl4] + NO + H2O.
Действие царской водки объясняется тем, что концентрированная HNO3 окисляет НСl по реакции (*) до свободного хлора, который в момент выделения является очень сильным окислителем. По этой причине при растворении металлов в царской водке никогда не получаются соли азотной кислоты, а получаются соответствующие хлориды.
При нагревании или освещении HNO3 разлагается:
HNO3 t или hν→ NO2 + O2 + H2O.
Применение.Большие количества азотной кислоты расходуются на приготовление азотных удобрений, взрывчатых и лекарственных веществ, красителей пластмасс, искусственных волокон и др. материалов. Дымящая азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
Разложение нитратов. При нагревании твердых нитратов практически все они разлагаются с выделением кислорода (единственным исключением является нитрат аммония), при этом все нитраты можно разделить на четыре группы.
Первую группу составляют нитраты щелочных металлов (в ряду активности до магния), которые при нагревании разлагаются на нитриты и кислород, например:
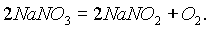
Вторую группу составляет большинство нитратов менее активных металлов (от щелочноземельных металлов до меди включительно), которые разлагаются на оксид металла, NO2 и кислород:


Третью группу составляют нитраты наиболее тяжелых металлов (правее меди), разлагающиеся до свободного металла, NO2 и кислорода:
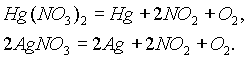
Четвертую группу составляет нитрат аммония.

Фосфор
Фосфор — аналог азота. Однако по сравнению с атомом азота атом фосфора характеризуется меньшей энергией ионизации и имеет больший радиус. Это означает, что неметаллические признаки у фосфора выражены слабее, чем у азота. Поэтому для фосфора реже встречается степень окисления -3 и чаще +5. Степени окисления: -3, 0, +1, +3, +4, +5.
Физические свойства.Фосфор — один из распространенных элементов в земной коре. В свободном состоянии в природе фосфор не встречается из-за высокой химической активности. Фосфор в отличие от азота имеет несколько аллотропных модификаций (всего 11): белый, красный, черный - наиболее изучены.
Белый фосфор — бесцветное и очень ядовитое вещество. Получается конденсацией паров фосфора. Не растворяется в воде, но хорошо растворяется в сероуглероде, легкоплавок, химически активен. При длительном слабом нагревании белый фосфор переходит в красный.
Красный фосфор — порошок красно-бурого цвета, не ядовит. Нерастворим в воде и сероуглероде. Установлено, что красный фосфор представляет собой смесь нескольких аллотропных модификаций, которые отличаются друг от друга цветом (от алого до фиолетового) и некоторыми другими свойствами. Свойства красного фосфора во многом зависят от условий его получения.
Черный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Получается длительным нагреванием белого фосфора при очень большом давлении (200°С и 1200 МПа).
Красный и черный фосфор при сильном нагревании возгоняются.
Природный фосфор состоит из одного стабильного изотопа 3115P. Широкое применение нашел искусственный радиоактивный изотоп 3215P (период полураспада 14,3 суток).

Свойства аллотропных модификаций фосфора объясняются их строением. Более подробно изучено строение белого фосфора. Он имеет молекулярную кристаллическую решетку. Его молекулы четырехатомны (P4 — тетрафосфор) и имеют форму правильной трехгранной пирамиды. Как все вещества с молекулярной решеткой, белый фосфор легко плавится и летуч. Он хорошо растворяется в органических растворителях.
В отличие от белого фосфора красный и черный фосфоры имеют атомную кристаллическую решетку. Поэтому они нерастворимы почти во всех растворителях, не летучи и, как уже отмечалось, не ядовиты.
Нахождение в природе.Общее содержание фосфора в земной коре составляет 0,08%. В связанном виде он входит в состав многих минералов, главным образом апатитов 3Ca3(РО4)2∙СаX2 (где X = F, Cl, OH) и фосфатов Са3(РO4)2. Разновидности апатита слагают осадочные горные породы — фосфориты, фосфор входит также в состав белковых веществ в виде различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, в мышцах - 0,27%.
Самые богатые в мире залежи апатитов находятся близ г. Кировска на Кольском полуострове. Фосфориты широко распространены на Урале, в Поволжье, в Сибири, Казахстане, Эстонии, Белоруси и др. Большие месторождения фосфоритов имеются в Северной Африке, Сирии и США. Фосфор необходим для жизни растений. Поэтому почва всегда должна содержать достаточное количество соединений фосфора.
Получение.Обычно белый фосфор получают из фосфата кальция при нагревании его в смеси с песком и углем в электрической печи без доступа воздуха:
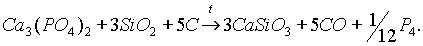
Красный фосфор можно получить при нагревании жидкого белого фосфора без доступа воздуха при температуре около 300 °С при небольшом давлении. При нагревании белого фосфора при большом давлении можно получить и черный фосфор.
Поскольку красный и черный фосфор являются полимерными модификациями, по сравнению с белым у них следует ожидать повышения температур плавления и температур кипения. Действительно, для красного фосфора Тпл составляет 600°С (под давлением).
Применение.Красный фосфор применяется для производства спичек. Из красного фосфора, сульфида сурьмы (III), железного сурика [природного оксида железа (III) с примесью кварца] и клея приготовляют смесь, которую наносят на боковые поверхности спичечной коробки. Головка спичек состоит главным образом из бертолетовой соли, молотого стекла, серы и клея. При трении головки о намазку спичечной коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево.
Белый фосфор широкого применения не имеет. Обычно его используют для образования дымовых завес. Черный фосфор применяется очень редко.
Химические свойства.В химическом отношении белый фосфор сильно отличается от красного. Так, белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240° С. При окислении белый фосфор светится в темноте — происходит непосредственное превращение химической энергии в световую. Поскольку температура плавления фосфора мала (44 °С), то давление насыщенных паров фосфора над твердым фосфором при обычных условиях достаточно велико — это и является причиной того, что белый фосфор “светится” в темноте. МолекулыP4 присутствующие в парах над поверхностью, окисляются кислородом с выделением света.
Фосфор химически активен и непосредственно взаимодействует с большинством простых веществ. Электронная конфигурация внешнего слоя фосфора 3s23p3, поэтому для фосфора наиболее характерны степени окисления 5+ (Н3РO4), 3+ (РСl3) и 3- (РН3 фосфин), 1+ (NaH2PO2 гипофосфит натрия)
Из трех аллотропных модификаций наиболее активным является белый фосфор. При обычных условиях на воздухе тонко измельченный фосфор самовоспламеняется:
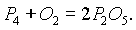
При недостатке кислорода образуется оксид фосфора (III):
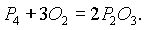
Красный и черный фосфор вступают в химические реакции при более высоких температурах. Аналогично азоту фосфор может взаимодействовать с металлами, образуя фосфиды, например:
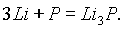
Фосфор соединяется со многими простыми веществами — кислородом, галогенами, серой, проявляя окислительные и восстановительные свойства:
P + Cl2(нед.) → PCl3 (фосфор восстановитель)
P + Cl2(изб.) → PCl5
Хлориды фосфора подвергаются гидролизу:
PCl3 + H2O ↔ H3PO3 + HCl
PCl5 + H2O ↔ POCl3 + HCl
При избытке воды идёт вторая ступень гидролиза:
POCl3 + H2Oизб. ↔ H3PO4 + HCl
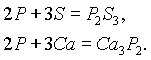 (фосфор окислитель с активными металлами)
(фосфор окислитель с активными металлами)
При взаимодействии фосфидов с водой выделяется фосфин РН3:
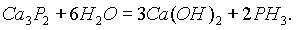
Оксиды фосфора. Фосфор образует несколько оксидов. Важнейшими из них являются Р4O6 и Р4О10. Часто их формулы пишут в упрощенном виде как Р2О3и P2O5 (индексы предыдущих разделены на 2). Оксиды и все кислородные соединения фосфора намного прочнее аналогичных соединений азота, что следует объяснить ослаблением неметаллических свойств у фосфора по сравнению с азотом.
Оксид фосфора (III) Р4O6 воскообразная кристаллическая масса, плавящаяся при 22,5°С, получается сжиганием фосфора при недостатке кислорода. Сильный восстановитель. Очень ядовит.
При нагревании на воздухе он переходит в Р2О5 (а постепенно окисляется уже в обычных условиях). Взаимодействуя с холодной водой, Р2О3 медленно образует фосфористую кислоту:
Р2О3 + Н2Охол. → Н3РО3.
В горячей воде диспропорционирует:
Р2О3 + Н2Огор. → Н3РО4 + РН3.
Оксид фосфора (V) Р4О10 белый гигроскопичный порошок, в органических растворителях Р2О5 хорошо растворим. Получается при горении фосфора в избытке воздуха или кислорода. Он очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Взаимодействие Р2О5 с водой в зависимости от числа присоединённых молекул Н2О приводит к образованию следующих основных гидратных форм:
Р2О5 + Н2О = 2 НРО3 (метафосфорная кислота)
Р2О5 + 2 Н2О = 2 Н4Р2О7 (пирофосфорная кислота)
Р2О5 + 3 Н2О = 2 Н3РО4 (ортофосфорная кислота).
Реакция медленного окисления фосфора кислородом воздуха интересна с различных сторон. Прежде всего, она сопровождается свечением, которое хорошо видно в темноте. Параллельно с окислением фосфора всегда происходит образование озона. Обусловлено это промежуточным возникновением радикала фосфорила (РО) по схеме: Р + О2 = РО + О и последующей побочной реакцией О + О2 = О3. Наконец, с окислением фосфора связана ионизация окружающего воздуха, что резко сказывается на его электропроводности. Этот эффект наблюдается и при некоторых других химических процессах, например при окислении на воздухе натрия или калия.
Выделение света при протекающих без заметного разогревания химических реакциях называется хемилюминесценцией. Она наблюдается не только при медленном окислении фосфора, но и при некоторых других химических и биохимических процессах, которыми обусловлено, в частности, свечение светляков, гнилушек и т. д. Зелёная хемилюминесценция фосфора во влажных средах связана с промежуточным образованием молекулы НРО.
|
из
5.00
|
Обсуждение в статье: NO оксид монооксид азота (II) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

