 |
Главная |
MnS, ZnS, FeS, CoS, NiS
|
из
5.00
|
Сульфиды нерастворимые в воде и в кислотах:
CuS, Ag2S, As2S3, HgS, Bi2S3, PbS, Sb2S3, CdS и др.
Получение сульфидов:
· Если сульфид металла нерастворим в кислотах, то его получают действием H2S на соли: CdCl2 + H2S → CdS + HCl.
· Если сульфид металла растворим в кислотах, то его получают действием Na2S на соли: MnCl2 + Na2S → MnS + NaCl.
· Если растворим в воде, то реакцией нейтрализации:
NaOH + H2S → Na2S + H2O.
v Взаимодействием простых веществ:
Zn + S t→ ZnS
Hg + S t→ HgS.
Некоторые сульфиды имеют характерную окраску: CuS и PbS— черную, CdS — желтую, ZnS— белую, MnS — розовую, SnS — коричневую, Sb2S3— оранжевую и т. д. На различной растворимоcти сульфидов и различной окраске многих из них основан качественный анализ катионов.
Нахождение в природе. Сероводород встречается в природе в вулканических газах и в водах некоторых минеральных источников, например Пятигорска, Мацесты. Он образуется при гниении серосодержащих органических веществ различных растительных и животных остатков. Этим объясняется характерный неприятный запах сточных вод, выгребных ям и свалок мусора.
Ранее отмечалось, что атомы серы склонны соединятся в зигзагообразные цепочки, это приводит к образованию многосернистых водородах (называются сульфаны).
Общая формула H2Sn (n = 2÷23) – жёлтые маслянистые жидкости, образуются при действии кислот на полисульфиды. Полисульфиды можно получить при кипячении сульфидов с серой: Na2S + S → Na2S2.
(FeS2 – пирит)
Могут быть окислителями (Na2S2 + SnS → Na2S + SnS2) и восстановителями (FeS2 + O2 → Fe2O3 + SO2), участвовать в реакциях диспропорционирования (Na2S2 → Na2S + S).
Оксид серы (IV).Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до -10° С сжижается в бесцветную жидкость. В жидком виде его хранят в стальных баллонах.
Он хорошо растворим в воде (40 объемов в 1 объеме воды при 20 °С).
Получение.В лаборатории оксид серы (IV) получают взаимодействием гидросульфита натрия с серной кислотой:

а также нагреванием меди с концентрированной серной кислотой:

Оксид серы (IV) образуется также при сжигании серы:
S + O2 t→ SO2
В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.). Образующийся в этих условиях оксид серы (IV) SO2 употребляется, главным образом, для получения оксида серы (VI) SO3 и серной кислоты.
FeS2 + O2 t→ Fe2O3 + SO2↑
ZnS + O2 t→ ZnO + SO2↑
Структурная формула молекулы SO2:

Как видим, в образовании связей в молекуле SO2 принимают участие четыре электрона серы и четыре электрона от двух атомов кислорода. Взаимное отталкивание связывающих электронных пар и неподеленной электронной пары атома серы придает молекуле угловую форму.
Оксид серы (IV) проявляет все свойства кислотных оксидов.
Сернистая кислота. При растворении SO2 в воде частично происходит реакция с водой и образуется слабая сернистая кислота H2SO3:

которая малоустойчива, легко распадается вновь на SO2 и Н2О. В водном растворе сернистого газа одновременно существуют следующие равновесия:

Константа диссоциации H2SO3 по первой ступени равна K1 = 1,6∙10-2, по второй — K2 = 6,3∙10-8. Являясь двухосновной кислотой, она дает два ряда солей: средние — сульфиты и кислые — гидросульфиты.
Сульфиты образуются при полной нейтрализации кислоты щелочью:

Из сульфитов в воде растворимы соли щелочных металлов.
Гидросульфиты получаются при недостатке щелочи (по сравнению с количеством, необходимым для полной нейтрализации кислоты):

Гидросулифиты легко растворимы.
Как и оксид серы (IV), сернистая кислота и ее соли являются сильными восстановителями. При этом степень окисления серы возрастает. Так, H2SO3 и её соли легко окисляется в серную кислоту даже кислородом воздуха:
H2SO3 + O2 → H2SO4
Na2SO3 + O2 → Na2SO4.
Поэтому долго хранившиеся растворы сернистой кислоты всегда содержат серную кислоту.
Еще легче протекает окисление сернистой кислоты бромом и перманганатом калия:

SO2 + Cl2 + H2O → H2SO4 + HCl
Химические реакции, характерные для SO2, сернистой кислоты и ее солей, можно разделить на три группы:
1. Реакции, протекающие без изменения степени окисления, например:

PCl5 + SO2 → SOCl2 + POCl3
Хлорид тионила – это хлорангидрид сернистой кислоты.
SOCl2 + H2O ↔ H2SO3 + HCl (гидролиз)
2. Реакции, сопровождающиеся повышением степени окисления серы от 4+ до 6+:

SO2 + Cl2 → SO2Cl2
Хлорид сульфурила – это хлорангидрид серной кислоты.
SO2Cl2 + H2O ↔ H2SO4 + HCl
Кислородом воздуха SO2 окисляется с большим трудом в присутствии катализатора.
При кипячении сульфитов с серой образуются тиосульфаты:
Na2SO3 + S t→ Na2S2O3
Почти все тиосульфаты растворимы, кроме солей свинца, серебра, таллия и бария. Тиосульфаты устойчивы в нейтральной и щелочной среде, в кислой они разлагаются:
Na2SO3 + HCl → H2S2O3 + NaCl
H2S2O3 → S + SO2 + H2O

Так как один атом серы находится в степени окисления -2, тиосульфаты являются сильными восстановителями:
Na2S2O3 + Cl2 + H2O → Na2SO4 + HCl + H2SO4
Na2S2O3 + I2 → Na2S4O6 + NaI
Тетратионат натрия – образуется при действии более мягких окислителей (I2).
3. Реакции, протекающие с понижением степени окисления серы, например уже отмеченное выше взаимодействие SO2 с H2S.
Таким образом, SO2, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства.
Применение.Оксид серы (IV) и сернистая кислота обесцвечивают многие красители, образуя с ними бесцветные соединения. Последние могут снова разлагаться при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действие SO2 и H2SO3 отличается от белящего действия хлора. Обычно оксидом серы (IV) белят шерсть, шелк и солому (хлорной водой эти материалы разрушаются).
Оксид серы (IV) убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др. Используют также при перевозке и хранении фруктов и ягод. В больших количествах оксид серы (IV) используется для получения серной кислоты.
Важное применение находит раствор гидросульфита кальция Са(НSO3)2 (сульфитный щелок), которым обрабатывают волокна древесины и бумажную массу.
Оксид серы (VI).SO3 — вещество с tпл= 16,8 °С и tкип= 44,8 °С. Оксид серы (VI), или триоксид серы, — это бесцветная жидкость, затвердевающая при температуре ниже 17° С в твердую кристаллическую массу. Оксид серы (VI) обладает всеми свойствами кислотных оксидов. Он является промежуточным продуктом производства серной кислоты.
При обычных условиях это снегообразная гигроскопичная масса (жадно поглощает воду). В парообразном состоянии – мономер, в жидком – триммер, в твёрдом – полимер.
Получение. Оксид серы (VI) в промышленности получают окислением SO2 кислородом только в присутствии катализатора (kt – V2O5):
SO2 + O2 ↔ SO3
Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход SO3 (т. е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
Молекула SO3 имеет форму треугольника, в центре которого находится атом серы:
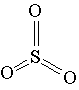
Такое строение обусловлено взаимным отталкиванием связывающих электронных пар. На их образование атом серы предоставил все шесть внешних электронов.
Серная кислота. Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту:
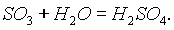
SO3 очень хорошо растворяется в 100%-ной серной кислоте. Раствор S03 в такой кислоте называется олеумом.
Физические свойства. Серная кислота — тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтомунельзя воду приливать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надосерную кислоту приливать небольшими количествами к воде.
Безводная серная кислота растворяет до 70% оксида серы (VI). При обычной температуре она не летуча и не имеет запаха. При нагревании отщепляет SO3 до тех пор, пока не образуется раствор, содержащий 98,3% Н2SO4. Безводная Н2SO4 почти не проводит электрический ток.
Химические свойства. Концентрированная серная кислота обугливает органические вещества — сахар, бумагу, дерево, волокна и т. д., отнимая от них элементы воды. При этом образуются гидраты серной кислоты. Обугливание сахара можно выразить уравнением

Образовавшийся уголь частично вступает во взаимодействие с кислотой:
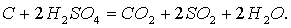
Поэтому кислота, которая идет в продажу, имеет бурый цвет от случайно попавших и обуглившихся в ней пыли и органических веществ.
На поглощении (отнятии) воды серной кислотой основана осушка газов.
Как сильная нелетучая кислота H2SO4 вытесняет другие кислоты из сухих солей:

Однако если Н2SO4 добавляется к растворам солей, то вытеснения кислот не происходит.
Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений левее водорода, за счет ионов Н+:

Cu + H2SO4(разб.) ≠
C + H2SO4(разб.) ≠
Концентрированная серная кислота – сильный окислитель, реагирует с неметаллами и металлами, стоящими до и после водорода.

 С активными металлами, например, цинком:
С активными металлами, например, цинком:
Zn + H2SO4(конц.) → ZnSO4 + H2S + H2O
Цинк восстанавливает серу до минимальной степени окисления.
Побочные продукты – S, SO2.
Отношение серной кислоты к железу и свинцу:
Железо хорошо растворимо в разбавленной и умеренно концентрированной H2SO4, но не растворяется в H2SO4(конц.), т.к. происходит пассивация металла (образуются оксиды железа). Поэтому H2SO4(конц.) перевозят в железных цистернах.
Свинец в разбавленной H2SO4 с поверхности покрывается мало растворимой плёнкой PbSO4, поэтому реакция дальше не идёт. В H2SO4(конц.) свинец легко растворяется.
Получений в промышленности.Два метода получения – контактный (основной) и нитрозный.
Контактный метод: оксид серы (IV), предварительно очищенный от примесей, окисляют при температуре ~5000С в присутствии катализаторов (V2O5 с добавками-активаторами Na2O и SiO2) кислородом воздуха в контактных аппаратах. Далее полученный SO3 поступает в абсорбер, орошается концентрированной 96-98%-ной серной кислотой, и образует олеум (H2S2O7).
Нитрозный метод: получают окислением SO2 в сернокислотном растворе, причём катализатором служит смесь оксидов азота NO и NO2. По нитрозному методу получают ~75% -ную H2SO4.
 2 SO2 + O2 + 2 H2O NO, NO2 2 H2SO4
2 SO2 + O2 + 2 H2O NO, NO2 2 H2SO4
Значение серной кислоты. Серная кислота является важнейшим
|
из
5.00
|
Обсуждение в статье: MnS, ZnS, FeS, CoS, NiS |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

