 |
Главная |
Геолого-промышленные типы урановых месторождений Казахстана
|
из
5.00
|
Урановая сырьевая база Казахстана представлена весьма многочисленными по генетической позиции месторождениями, связанными с разновозрастными структурно-формационными комплексами (рис. 1.2). Все известные геолого-промышленные типы урановых месторождений Казахстана можно объединить в три группы:
- экзогенные месторождения в мезозойско-кайнозойских образованиях;
- эндогенные месторождения в домезозойских образованиях;
- полигенные месторождения.
Экзогенная группа промышленных урановых месторождений Казахстана представлена четырьмя геолого-промышленными типами:
1) пластово-инфильтрационные (региональных зон пластового окисления), образованные пластовыми напорными водами при их латеральном движении;
2) грунтово-инфильтрационные (региональных зон грунтового окисления), образованные грунтово-пластовыми безнапорными водами при их нисходящем и частично латеральном движении;
3) ураноугольные, образованные грунтово-пластовыми безнапорными или слабонапорными водами при их нисходящем и частично латеральном движении;
4) органогенные-фосфатные, связанные с диагенетическим накоплением рудных компонентов в костном детрите рыб.
Урановые месторождения пластово-инфильтрационного типа, представлены достаточно широко в пределах Шу-Сарысуйской, Сырдарьинской и частично Илийской урановорудных провинций южного Казахстана.
Общие ресурсы, заключенные в месторождениях этого типа, весьма значительны и составляют около 75 % всех ресурсов урана Республики.
Промышленные объекты пластово-инфильтрационных месторождений представлены в Шу-Сарысуйской урановорудной провинции месторождениями Мынкудук, Жалпак, Акдала, Уванас, Канжуган, Моинкум, Инкай, Буденовское; в Сырдарьинской ураново-рудной провинции - месторождениями Северный и Южный Карамурун, Ирколь, Харасан, Заречное; в Илийской урановорудной провинции месторождением Сулучекинское.
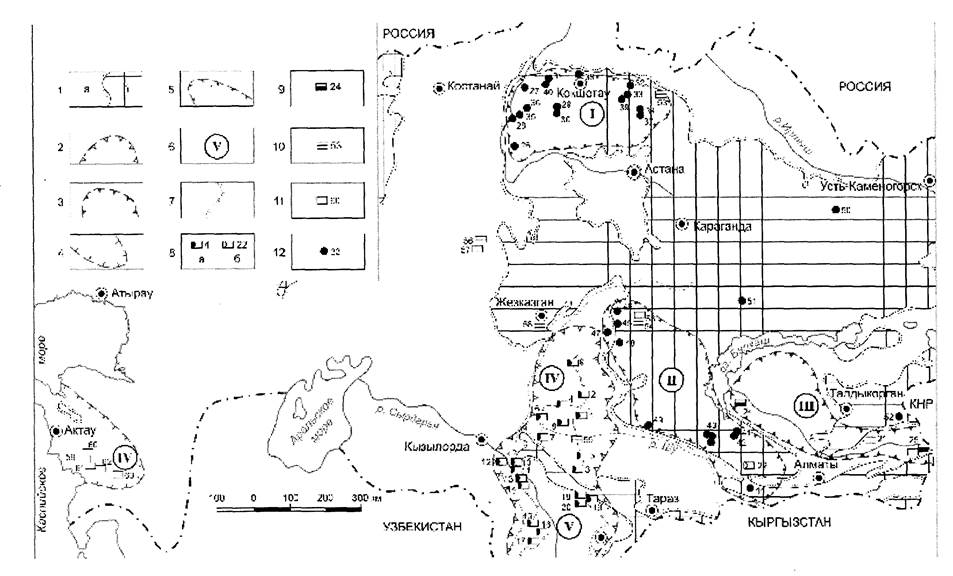
Рис. 1 – Схема размещения урановых месторождений в Казахстане.
Обозначения к рис. 1.
1- области распространения мезозойско-кайнозойских (а) и домезозойских (б) образований;
2-5 - границы УРП и УРР:
2 - УРП пластово инфильтрационных месторождений региональных ЗПО (Во-сточно-Туранская мегапровинция и составляющие ее УРП: IV - Чу-Сарысуйская, V - Сырдарьинская),
3 - УРП с эпигенитическими месторождениями грунтово-инфильтрационного и пластово-инфильтрационного типов в отложениях J, 2 (III - Илийская УРП),
4 - УРП седиментационно-диагенетических месторождений в связи с костным рыбным детритом (VI - Прикаспийский УРР),
5 - УРП эндогенных (гидротермальных) месторождений (I - Северо-Казах-станская, II - Кендыктас-Чу-Или-Бетпакдалинская УРП);
6 - номера УРП и УРР на схеме,
7 - рудоконтролирующие региональные фронты ЗПО, 8-10 - типы месторождений урана и их номера:
8 - пластово-инфильтрационные в мезозойско-кайнозойских (а) и домезозойских (б) образованиях;
9-10 - эпигенетические грунтово-инфильтрационные ураноугольные (9) и эк-зодиагенетические грунтово-инфильтрационные в песчсано-глинистых пластах (10);
11 - синдиагенетические в связи с костным рыбным детритом;
12 - эндогенные (гидротермальные).
Урановые месторождения на схеме: 1 - Уванас, 2 - Жалпак, 3 - Канжуган, 4 - Мынкудук, 5 - Моинкум, 6 - Инкай, 7 - Буденовское, 8 - Шолак-Эспе, 9 - Каракоин, 10 - Северный Карамурун, 11 -Южный Карамурун, 12 - Ирколь, 13 - Северный Харасан, 14 - Южный Харасан, 15
- Заречное, 16 - Жауткан, 17 - Асарчик, 18 - Кызылколь, 19 - Чаян, 20 - Лунное (Каратау), 21 - Сулучекинское, 22 - Копылсай, 23 - Семизбай, 24 — Нижнеилийское, 25 - Кольджат, 26 - Кубасадыр, 27 - Восход, 28 - Ишимское, 29 - Дергачевское, 30
- Восток, Звездное, 31 - Грачевское, 32 - Шатское, 33 - Тастыколь, Заозерное, 34 -Кербайское, 35 - Камышовое, 36 - Викторовское, 37 - Мынбай, Аксу, 38 - Славянское, 39 - Коксорское, 40 - Косачиное, 41 - Ботабурум, 42 - Джусадалинское, 43 -Кызылсайская группа, 44 - Курдай, 45 - Джидели, 46 - Безымянное, 47 - Шорлы, Костобе, 48 - Даба, 49 - Курманчите, 50 - Улькен-Акжал, 51 - Кызыл, 52 - Панфиловское, 53 - Талас, 54 - Гранитное, 55 - Барс, 56 - Лазаревское, 57 - Лунное (Торгай), 58 - Курай, 59 - Меловое, 60 - Томак, 61 - Тасмурун, 62 - Тайбагар, 63 -Кырынтарыкское рудное поле.
Анализ достоверно разведаных урановых запасов мира по их вкладу в общее производство урана показывает, что ведущими геолого-промышленными типами в настоящее время являются месторождения урана типа «зон несогласия» (49 %), брекчеевого комплекса (26 %) и месторождения «песчаникового» типа (19 %). По прогнозу МАГАТЭ к 2025 г. доля месторождений «песчаникового» типа в общем уровне производства составит 33 % при 17 % месторождений типа «зон несогласия» (рис. 3).
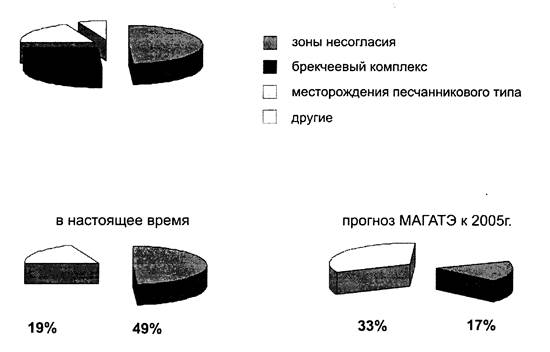
Рис. 2 – Анализ достоверно разведанных урановых запасов мира по их вкладу в общее производство урана
То есть, роль месторождений «песчаникового» типа приобретает все большую значимость. Месторождения «песчаникового» типа наиболее широко проявлены на территории Республики Казахстан и составляют около 75 % от суммарных запасов и ресурсов Казахстана.
Промышленные месторождения «песчаникового» типа сосредоточены в основном в пределах Шу-Сарысуйской и Сырдарьинской урановорудных провинций и лишь два месторождения этого типа (Сулучекинское и Актау) находятся в Илийской урановорудной провинции.
В крупнейшей на Евразийском континенте Шу-Сарысуйской провинции сосредоточены крупные и уникальные урановые месторождения, разведанные запасы и достоверные ресурсы которых составляют десятки и первые сотни тысяч тонн. В горизонтах верхне-мелового периода локализуются уникальные месторождения: Мынкудук, Инкай и Буденовское, а также Жалпак и Шолпак-Эспе. К отложениям палеогена приурочены месторождения: Уванас, Канжуган и Моинкум.
В меловых отложениях Сырдарьинской провинции размещаются месторождения Северный и Южный Карамурун, Ирколь, Заречное, Жоуткан и Асарчик. С палеогеновыми отложениями связаны незначительные по масштабам объекты: Кызыл-Коль, Чаян, Лунное.
К общим особенностям месторождений «песчаникового типа» Казахстана относятся следующие:
1. Урановорудные залежи имеют протяженность вдоль границ пластовых зон окисления до 20-30 и более километров. В плане они образуют извилистые ленты шириной от 50 до 800 м, реже образуют изометрические тела, а также линзы и неправильные тела.
2. Урановые руды обычно бедны, со средним содержанием металла 0,035-0,07 %. Контрастность руд обычно находится в прямой зависимости от содержания в породах углефицированного растительного вещества. Рудные залежи имеют относительно высокую среднюю мощность (3,5-8 м) и значительную продуктивность - в среднем 3-7,5 кг/м2 .
3. По составу рудных компонентов среди месторождений этого типа выделяются: собственно урановые; урановые с примесью рения; селено-урановые и урано-ванадиевые. Рениеносные тела со средней концентрацией рения от 0,1 до 1 г/т локализуются, как правило, в контурах урановорудных песчаных залежей. Очень часто концентрация рения прямо коррелируется с содержанием урана и углистого вещества. Собственно урановые и рениевоносные урановые месторождения характерны для Шу-Сарысуйской провинции. В Сырдарьинской провинции преобладают селено-урановые и ванадий урановые месторождения.
4. Урановая минерализация представлена тонкодисперсными формами настурана и коффинита, концентрирующихся в поровом алевро-глинистом заполнителе рудных песков. В процессе подземного выщелачивания они легко дезинтегрируются с извлечением урана в раствор. Руды некарбонатные (содержание С02 - 0,01-0,3 %, редко выше).
Лекция № 2Поведение урана в водных растворах
Поведение металлов в водных растворах во многом определяет выбор экстрагента, поэтому прежде чем говорить о процессе извлечения металлов из водных растворов, необходимо рассмотреть способы получения таких растворов и вероятность нахождения металлов (особенно поливалентных) в форме ионов. Поведение металлов в водных растворах зависит от состава исходного рудного сырья и выборе реагентов для перевода металлов в водную фазу.
В зависимости от природного химического состава руды, ее физических свойств и других факторов производится выбор технологической схемы обработки сырья. Обычно химическая обработка урановых руд состоит из двух основных циклов:
– получение химического концентрата, который представляет собой техническую смесь оксидов урана, диуранат натрия или диуранат аммония;
– аффинаж химического концентрата с получением необходимых соединений высокой чистоты.
В свою очередь, в каждый из этих циклов входит несколько стадий переработки, определяющих технологическую цепочку данного цикла. Так, первый цикл чаще всего представляет собой ряд последовательных операций: подготовка руд к гидрометаллургическому переделу → разложение урановых руд методом выщелачивания → ионный обмен → экстракция → осаждение и очистка, причем в зависимости от выбранного способа разложения и качества получаемых продуктивных растворов могут быть исключены отдельные операции. В результате такой технологической цепочки получают концентрат, содержащий более 70 % урана в виде различных соединений.
Подготовка руд к гидрометаллургическому переделу обычно включает в себя дробление и измельчение руд, различные методы обогащения (иногда их совокупность) и очень редко – обжиг рудного сырья.
В промышленной практике для разложения урановых руд чаще всего используются 2 метода: кислотное и карбонатное выщелачивание. Выбор метода зависит от качественного состава руды.
Кислотный метод используют для разложения урановых руд, в которых уран связан с труднорастворимыми оксидами тория, ниобия, тантала, редкоземельных элементов и руд с высоким содержанием гипса и сульфидов.
Для руд, у которых пустая порода состоит из доломита, кальцита и магнезита, преимущественно применяют карбонатное выщелачивание.
Реагенты для кислотного метода. Для получения урановых концентратов чаще других используют кислотное выщелачивание в разбавленной серной кислоте с добавлением в случае необходимости окислителей. При кислотном выщелачивании могут быть использованы также азотная и соляная кислоты, но при этом передел становится значительно дороже.
Реагенты для карбонатного метода. При разложении урановых руд карбонатным методом применяют щелочные карбонатные растворы. Карбонатный метод обладает рядом преимуществ: менее интенсивно корродирует оборудование и улучшается фильтрация растворов.
Кислотное выщелачивание.Степень извлечения урана из руд кислотным выщелачиванием зависит от следующих технологических факторов: концентрации кислоты, степени окисления основных минералов урана, температуры выщелачивания, размера частиц и характера связи минералов урана с другими минералами.
При сернокислотном выщелачивании уран переходит в раствор в виде иона уранила по реакции:
UO3 тв + 2Н+водн → UO22+водн + Н2Оводн. (1)
Однако подобная запись не отражает полноценного состояния урана в водных растворах. С позиции современной химии комплексных соединений предполагают существование нескольких аквакомплексов:
1) катионного комплекса [UO2(H2O)6]2+;
2) нейтральных комплексов [UO2(H2O)4SO4]0; [UO2(H2O)3SO4]n;
[UO2(H2O)2SO4]0; [UO2(H2O)SO4]0n
Преимущественное образование того или иного комплекса зависит от активности урана, кислоты и температуры. Реакция растворения UO3 в серной кислоте очень сложна, с учетом существования аквакомплексов её можно написать так
UO3 тв + H2SO4 водн + 3H2O водн → [UO2 (H2O) 4SO4]0. (2)
Помимо явлений гидратации и образования аквакомплексов в растворах уранил-сульфата наблюдается комплексообразование уранил-иона с сульфат – и бисульфат-ионами.
UO22+ + HSO4- = [UO2 (SO4)] + H+; (3)
UO22+ + SO42- = [UO2 (SO4)]; (4)
UO22+ + 2SO42- = [UO2 (SO4)2]2-; (5)
UO22+ + 3SO42- = [UO2 (SO4)3]4-. (6)
Обычно в растворах присутствуют фактически все формы комплексов. Растворимость в воде уранил-сульфата очень велика (61,2 % при 25 оС). Реакция растворов кислая. С увеличением концентрации раствора рН падает. Так, при концентрации раствора 0,3 моль/л рН 2, а при концентрации 3 моль/л рН 0,5.
Кислотность раствора должна предотвращать осаждение урана из раствора не только при выщелачивании, но и при дальнейшей переработке продуктивных растворов, обычно к концу выщелачивания рН раствора поддерживают в пределах 1-2 (3-7 г/л кислоты). В раствор переходит и некоторая часть сопутствующих примесей.
Так, кремнезем при комнатной температуре плохо взаимодействует с серной кислотой, но его растворимость повышается при росте температуры до 1 %:
n SiO2+n H2O  [H2SiO3]n (7)
[H2SiO3]n (7)
Глинозем, содержащийся в руде, взаимодействует с серной кислотой по реакции:
Al2O3+3H2SO4= Al2(SO4)3+3H2O, (8)
причем степень перехода глинозема в раствор не превышает 5 %.
Оксид трехвалентного железа переходит в раствор на 6-8 % по реакции:
Fe2O3 + 3H2SO4 = Fe(SO4)3 + 3H2O (9)
Значительно лучше растворяется в разбавленных кислотах оксид железа (II) (40-50 %) по реакции:
FeO + H2SO4 = FeSO4 + H2O (10)
Железо, находящееся в рудах в сульфидной форме, с сернокислыми растворами не взаимодействует. Карбонат железа полностью переходит в раствор:
FeСO3 + H2SO4 = FeSO4 + H2O + СО2 (11)
Карбонаты кальция и магния взаимодействуют с разбавленной серной кислотой с образованием малорастворимого сульфатов кальция, сульфат магния остается в растворе. Фосфор в рудах находится в виде фосфорита Са3(РО4)2 или апатита Са5(РО4)3F(Cl). При взаимодействии с разбавленной Н2SO4 эти минералы растворяются практически полностью (до 95-98 %) с образованием фосфорной кислоты. Частично переходят в раствор также примеси Сu, Ni, Cr, Mn, Ti, As, Sb и др.
Так как карбонаты кальция и магния реагируют с серной кислотой практически полностью, то применение кислотного выщелачивания для руд, содержащих более 5 % Са(Mg)СО3, нецелесообразно из-за большого расхода H2SO4 и загипсовывания рудных тел. Для таких руд целесообразно использовать карбонатное выщелачивание или удалять карбонаты флотацией или обжигом.
Окислители, применяемые при кислотном выщелачивании урана.
Так как уран чаще всего содержится в труднорастворимых соединениях со степенью окисления (+4), необходимо применять окислитель. Одним из окислителей является оксид трехвалентного железа, окисление наиболее эффективно протекает по реакции (12) при соотношении Fe+3/Fe+2 > 1:
UO2 + 2Fe+3 ↔ UO22+ + 2Fe2+. (12)
В качестве окислителей используют также пиролюзит MnO2 и NaClO3.
Скорость растворения урановых руд растет с повышением температуры, поэтому ее поддерживают не менее 40 оС, для руд, содержащих труднорастворимые минералы температура должна быть около 50 оС.
Измельчение руды не влияет на степень извлечения урана в случае подземного скважинного выщелачивания, в противном случае необходимо измельчение до крупности порядка 0,3-0,15 мм, хотя иногда необходимо более тонкое измельчение исходного сырья.
Выщелачивание высококремнистых урановых руд. Содержание карбонатов кальция и магния в таких рудах невелико, поэтому такие руды вскрывают серной кислотой. Пульпа с 65-70 % твердого выщелачивается серной кислотой с добавкой в качестве окислителя хлората натрия. Продолжительность выщелачивания при 60-65 oС составляет 48 часов; расход кислоты 50-55 кг, а хлората натрия 1-2 кг на тонну руды. Избыточную кислотность из-за трудности вскрываемости браннерита поддерживают на уровне 50-70 г/л. Для снижения расхода кислоты до 35-40 кг/т часть кислого раствора возвращают на выщелачивание исходной руды. Выщелачивание проводят в пачуках с воздушным перемешиванием. Извлечение урана составляет 95 %. По этой схеме работает один из крупнейших в мире урановых заводов «Кансолидейтед Денисон» производительностью около 6000 т/сутки руды.
Выщелачивание карнотитовых руд. Карнотитовые руды относятся к осадочному типу и представляют собой песчаники, содержащие карбонаты и глинистые материалы. Основной урановый минерал – карнотит; из других урановых минералов присутствует настуран и урановые черни. Содержание урана в руде около 0,25 %, ванадия 0,5 %. Руды сравнительно мягкие, поэтому их измельчают в одну стадию. Измельченный до 0,5 мм рудный материал выщелачивают серной кислотой; в качестве окислителя применяют марганцевую руду. Выщелачивание осуществляется в реакторах с механическим перемешиванием; продолжительность процесса 16-20 часов, значение pН среды 0,7-1,2. Расход серной кислоты при переработке этих руд в 2-3 раза больше, чем при переработке кварцитовых. В соответствии с этим растворы после выщелачивания сильнее загрязнены примесями, в частности в них содержится 1-5 г/л ванадия. Содержание урана в растворе колеблется от 0,5 до 1,5 г/л.
Выщелачивание урансодержащих фосфоритов. Фосфориты измельчают до 60 % - 200 меш и вскрывают серной кислотой в шести гуммированных реакторах в течении 12-18 часов при 70-75 oС. Реакция экзотермична, поэтому пульпу в реакторах охлаждают воздухом путем барботажа. Техническую фосфорную кислоту отделяют от гипса на ленточном вакуум-фильтре. Отфильтрованный раствор охлаждается до 40-45 oС, а затем поступает в отстойник, где происходит оседание твердых частиц. Расход серной кислоты 1 м3/т фосфорита, извлечение урана в химический концентрат 65 %.
Кислотное выщелачивание урановых руд под давлением. В технике выщелачивания под давлением известен способ, при помощи которого можно снизить расход реагентов. В США был разработан метод, по которому сульфидные минералы в виде водной суспензии можно окислить сжатым кислородом при температуре несколько выше 130 oС. Окисление протекает достаточно быстро, что делает этот метод экономичным для получения растворимых сульфатов. Этот метод можно использовать для обработки руд, в которых сульфиды железа ассоциируются с урановыми минералами; при этом получается серная кислота, необходимая для выщелачивания. Некоторые упорные руды, медленно растворяющиеся в концентрированном растворе серной кислоты, могут растворяться в менее концентрированном растворе с большей скоростью, если выщелачивание проводить при температуре больше 100 oС. При кислотном автоклавном выщелачивании смолковой руды, содержащей U – 0,144 %; Fe – 3,8 %; S – 4,4 %; Al2O3 – 1,3 %; CaO -0,1 %; SiO2 – 89 %, оптимальными условиями выщелачивания являются: температура 130-150 0С, парциальное давление кислорода 0,7-1 атм, продолжительность процесса 3-5 часов. При кислотном автоклавном выщелачивании под давлением кислорода совместно с ураном в раствор переходят медь, никель и кобальт, присутствующие в урановых рудах в форме сульфидов. При последующей переработке растворов могут быть комплексно извлечены и эти металлы. Положительным качеством выщелачивания в автоклаве под давлением кислорода является дешевизна и доступность используемых реагентов. Для пиритсодержащих руд единственным реагентом является кислород, а для руд, не содержащих пирита, - кислород и пирит. Процесс автоклавного выщелачивания урановых руд очень эффективен особенно при переработке упорных сульфидных руд. Так при автоклавном выщелачивании канадской сульфидной руды, содержащей 4,4 % сульфидной серы и 0,17 % урана в водной взвеси под давлением кислорода 10 атм извлечение урана в раствор составило 98 %. При использовании обычного метода выщелачивания извлечение урана в раствор не превышает 75 %, расход серной кислоты и пиролюзита очень велик, а растворы сильно загрязнены примесями. Аналогичные результаты были получены и для австралийской руды месторождения Рам-Джантл, содержащей 0,5 % урана.
Карбонатное выщелачивание. Для урансодержащих известняков и других урановых руд с большим содержанием извести (CaO) применение кислоты не допускается из-за большого расхода последнего; в таких случаях можно использовать только систему карбонатного выщелачивания. В карбонатных растворах уран и ванадий хорошо растворимы, что упрощает извлечение этих ценных компонентов из раствора.
При растворении урановой руды в карбонатных растворах образуются ионы уранилкарбоната. Образование этих ионов происходит по следующим реакциям:
– при выщелачивании карнотита:
K2(UO2)2(VO4)2·3H2O+6CO32–→ 2K++2[UO2(CO3)3]4–+2VO3–+4OH–+H2O, (13)
– при выщелачивании уранинита:
2UO2 + 6CO32– + O2 + 2H2O → 2[UO2(CO3)3]4– + 4OH–. (14)
Как видим, в результате растворения происходит накапливание ионов гидроксила, что может привести к осаждению соединений урана (например, диураната натрия) из раствора. Поэтому для нейтрализации иона гидроксила используют бикарбонат натрия. В случае присутствия урана в четырехвалентном состоянии или при наличия в рудах восстановителя обязательна добавка окислителя.
В качестве окислителей используют: кислород, перманагнат калия, гипохлорит натрия.
При карбонатном выщелачивании уран отделяется от большей части примесных элементов. Еще одним преимуществом карбонатного метода является возможность регенерации растворителя, когда через щелочной маточный раствор (после осаждения диураната натрия) пропускают углекислый газ, в результате чего образуются карбонат и бикарбонат.
Несмотря на эти преимущества, карбонатный метод во многих отношениях не является идеальным. К его недостаткам относятся меньшее извлечение, чем при кислотном выщелачивании. Карбонатный метод непригоден для руд с высоким содержанием гипса или сульфидов. Сгущение и фильтрация при работе с карбонатными растворами в отсутствии флоккулирующих агентов являются трудоемкими операциями. На тугоплавкие урановые минералы, например, эвксенит, бетафит, самарекит, браннерит, давидит, карбонатные растворы не оказывают заметного действия без предварительного плавления минералов.
Следует напомнить, что карбонатные растворы действуют на очень немногие урановые компоненты руды, а потому, если в частице руды уран окружен минералами пустой породы, он не будет выщелачиваться. Поэтому при карбонатном выщелачивании необходимо достаточно тонко измельчить руду, чтобы обнажить как можно большую часть уранового минерала. Требуемое измельчение зависит от характера руды. Например, для извлечения урана из песчаника требуется раздробить такие руды только до величины песчинок. В известняковых рудах урановые минералы присутствуют в виде проростков и включений совместно с кальцитом и флюритом. Чем тоньше дробление этих руд, вплоть до пылевидных частиц микронных размеров, тем больше возможное извлечение урана.
Лекция №3
Общие сведения о процессе экстракции
Общие понятия и терминология процессов экстракции.
Жидкостная экстракция – это процесс извлечения вещества, в частности ионов и соединений металлов, из водной фазы в жидкую органическую фазу, не смешивающуюся с водой. Последующей операцией, называемой реэкстракцией, экстрагированный металл опять переводят из органической фазы в водный раствор, чем достигается концентрирование и очистка металла от примесей.
Органическая фаза обычно содержит органическое вещество (собственно экстрагент), образующее с извлекаемым металлом комплексные или солевые соединения, способные растворятся в органической фазе. Иногда экстрагентом называют раствор органического реагента в разбавителе. Разбавитель – жидкое органическое вещество, не смешивающееся с водой, служащее растворителем экстрагента (керосин, ксилол, хлороформ, толуол и др.).
В качестве реэкстрагирующих растворов (реэкстрагентов) используют растворы кислот, солей и их оснований. В результате реэкстракции обычно достигается и регенерация экстрагента, т.е. восстановление его первоначальной способности к экстрагированию. Органическая и водная фазы после проведения экстракционной стадии называют соответственно экстрактом и рафинатом, а водный раствор после реэкстракции – реэкстрактом.
Для улучшения показателей экстракции в ряде случаев используют высаливатели, являющимися неорганическими веществами (обычно электролитами). Добавление в водный раствор высаливателя способствует образованию легче экстрагируемых недиссоциированных молекул или приводит к образованию экстрагируемых комплексов.
Одной из количественных характеристик экстракции является коэффициент распределения –  , который определяется, как отношение общих (аналитических) концентраций элемента в органической и водной фазах при установлении равновесия:
, который определяется, как отношение общих (аналитических) концентраций элемента в органической и водной фазах при установлении равновесия:
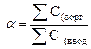 =
=  , (1)
, (1)
где С1,С2,…Сi – концентрация элемента в различных его химических формах в органической и водной фазах.
В частном случае, когда в органической и водной фазах соединение экстрагируемого элемента имеет одинаковый состав, выражение упрощается:
 =
=  d = С(орг)/С(вод) . (2)
d = С(орг)/С(вод) . (2)
Таким образом,  d – частный случай
d – частный случай  ;
;  d выражает известный закон распределения Нернста.
d выражает известный закон распределения Нернста.  d и
d и  не являются постоянными величинами и соответствуют определенным условиям экстракции. На практике обычно
не являются постоянными величинами и соответствуют определенным условиям экстракции. На практике обычно  ≥ 0,3 ч 0,5, так как в противном случае объем органической фазы увеличивается настолько, что применение жидкостной экстракции может стать экономически невыгодным.
≥ 0,3 ч 0,5, так как в противном случае объем органической фазы увеличивается настолько, что применение жидкостной экстракции может стать экономически невыгодным.
Селективность (избирательность) экстрагента по отношению к основному металлу (Ме1) для данной пары металлов (Ме1 и Ме2) определяется коэффициентом разделения:
в Ме1/Ме2 =  1/
1/  2 . (3)
2 . (3)
Практически применяют экстракционные системы с в ≥ 2, так как при меньших значениях резко возрастает число ступеней (повторных стадий) экстракции, необходимых для полного извлечения и очистки от примесей целевого металла.
Степень извлечения Е характеризует процент извлечения металла в органическую фазу от его содержания в обеих фазах. При одинаковых объемах водной и органической фаз:

 =
=  =
=  . (4)
. (4)
При разных объемах водной Vвод и органической Vорг фаз:

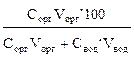 =
= 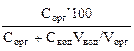 =
=  . (5)
. (5)
Классификация экстракционных процессов. Металлы в водных растворах электролитов находятся в виде гидратированных ионов. Реальная свободная энергия гидратации составляет обычно 40 (Ме+, Н+) – 130 (Ме3+) кДж/моль. Чтобы экстракция стала заметной, эта энергия должна быть скомпенсирована взаимодействием с экстрагентом, т.е. необходима свободная энергия сольватации порядка 40ч130 кДж/моль, что возможно при образовании электронейтральной молекулы или частичном освобождении от гидратной оболочки с получением гидрофобного соединения.
Отвечающие этому условию органические вещества можно подразделить на две группы.
К первой относятся нейтральные экстрагенты – органические вещества, молекулы которых способны к образованию координационных связей (донорно-акцепторного типа) с извлекаемым ионом.
Ко второй группе относятся органические кислоты и их соли, органические основания и их соли, способные при контакте с водным раствором к обмену неорганического катиона или аниона, входящего в состав экстрагента, на одноименный ион, находящийся в растворе.
В этом случае условием протекания экстракции является более высокая энергия гидратации ионов, переходящих из органической фазы в водную, по сравнению с извлекаемыми из водного раствора ионами. Экстрагенты этой группы называют жидкими ионообменниками. Их подразделяют на катионообменные и анионообменные в зависимости от вида обмениваемых ионов.
По механизму протекания экстракционные процессы разделят на следующие основные типы:
нейтральными экстрагентами;
анионообменная экстракция;
катионообменная экстракция;
простое физическое распределение;
смешанный механизм экстракции.
К нейтральным экстрагентам относят органические соединения, в составе которых имеются активные атомы, обладающие электроно-донорной способностью. Их можно подразделить
на кислородсодержащие (активный атом >О::);
азотсодержащие (активный атом >N:) и
серосодержащие (активный атом = S :: ).
Кислородсодержащие экстрагенты. Это наиболее многочисленная группа экстрагентов, используемых в гидрометаллургии. К ним относятся спирты R–ОН. В качестве экстрагентов обычно используют спирты с числом атомов углерода в радикале R, равным 6–12. При меньшей длине углеводородного радикала спирты заметно растворяются в воде, при большей – обладают высокой вязкостью. Наиболее удобны для экстракции вторичные
Н R2
| |
R1 – С – R2 или третичные R1 – С – R3 спирты.
| |
ОН OH
Часто применяют технические смеси спиртов, такие, как первичные спирты фракции С7чС9, вторичные – фракции С13чС19 и т.д.
Среди простых эфиров (R1–О–R2) можно выделить диэтиловый эфир С2Н5–О–С2Н5, который широко используют в аналитической химии. К нейтральным экстрагентам относятся также кетоны:
 R
R
 C = O.
C = O.
R
Применение в промышленном масштабе нашли метилизобутилкетон и циклогексанон:
| О || СН3– С – С4Н9 метилизобутилкетон (МИБК), |
Н2С СН2
 Н2С С = О
Н2С СН2
циклогексанон Н2С С = О
Н2С СН2
циклогексанон
|
Из нейтральных экстрагентов особое место занимают нейтральные фосфорорганические соединения (НФОС).
| Нейтральные эфиры ортофосфорной кислоты (фосфаты) | |
R1 O
 R2 O P O ,
R3 O
R2 O P O ,
R3 O
| к которым относится широко распространенный в промышленной практике реагент – трибутилфосфат (ТБФ) – (С4Н9О)3РО. |
| Нейтральные эфиры алкилфосфоновой кислоты (фосфонаты) имеют строение: | |
 R1 O
R2 O P O ,
R3 R1 O
R2 O P O ,
R3
| например, диизооктилметилфосфонат (С8Н17О)2(СН3)РО. |
| Эфиры диалкилфосфиновой кислоты (фосфинаты): | |
 R1 O
R2 P O,
R3 R1 O
R2 P O,
R3
| например, этилдигексил фосфинат (С2Н5О) (С6Н13)2РО. |
| Фосфиноксиды: | |
 R1
R2 P O ,
R3 R1
R2 P O ,
R3
| например, триоктилфосфиноксид (С8Н17)3РО. |
Известны нейтральные экстрагенты с центральным атомом серы – это диалкилсульфоксиды:
 R1
R1
S O
R2
например, диоктилсульфоксид (С8Н17)2SO и циклические сульфоксиды, нефтяные сульфоксиды, получаемые окислением сульфидов нефти.
Все рассмотренные выше экстрагенты имеют в составе молекулы группы, содержащие кислород. Электронное облако в молекуле экстрагента смещено к оксидному кислороду. Экстракционная способность зависит от полярности группы, а также сферической (пространственной) доступности кислорода.
Так, простые эфиры имеют меньшую способность присоединения катиона в связи с трудной доступностью кислорода в линейной молекуле эфира R–O–R. У кетонов и сложных эфиров фосфорной кислоты атомы кислорода намного доступнее, так как они связаны с углеродом или фосфором двойной связью (кетонная группа >С=О и фосфорильная группа >Р=О).
Кроме того, экстракционная способность зависит от того, с какими группами (заместителями) связан центральный атом.
Так, при замене в составе фосфата эфирных групп R–О алкильными заместителями (т.е. при наличии связи R–P) полярность фосфорильной группы увеличивается в ряду фосфат, фосфонат, фосфинат, фосфиноксид. Такая закономерность объясняется тем, что эфирный кислород оттягивает электронное облако от фосфорильного кислорода, что понижает полярность группы. Однако реэкстракция элемента из фокфиноксидов весьма затруднена из-за прочности образовавшегося его соединения в органической фазе. Поэтому используют главным образом фосфаты.
Очень важную группу нейтральных экстрагентов составляют амины, являющиеся алкильными производными аммиака. В зависимости от числа протонов, замещенных в аммиаке алкильными радикалами, различают первичные, вторичные и третичные амины: RNH2, R2NH и R3N. Из первичных аминов в промышленности используют алкиламиины с линейным радикалами, содержащими 7-23 атомов углерода, а также амины с разветвленными радикалами различного строения, например 1,1',1"– триалкиламины:
 R1 H
R1 H



 R2 C N ,
R2 C N ,

R3 H
к которым относятся экстрагенты с фирменными названиями Амберлит XLA-3.
Распространенными из вторич
|
из
5.00
|
Обсуждение в статье: Геолого-промышленные типы урановых месторождений Казахстана |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

