 |
Главная |
Кинетика процессов экстракции
|
из
5.00
|
Общие сведения.
Экстракцию можно рассматривать как процесс массопередачи, происходящий в результате существования разности химических потенциалов переносимых веществ в фазах. В общем случае массопередача сопровождается химическими реакциями. При экстракции неорганических веществ они протекают практически всегда, так как в основе такого процесса обычно лежит химическое взаимодействие извлекаемых компонентов с экстрагентом. В зависимости от типа экстрагируемого вещества и его состояние в водном и органическом растворах в системе могут протекать самые разнообразные химические реакции. Однако общим для всех типов экстракционных систем являются реакции, предшествующие образованию экстрагируемого соединения, и реакции образования экстрагируемого соединения.
Указанные реакции могут протекать в объемах фаз, в слоях, непосредственно прилегающих к границе раздела, а также на самой границе раздела фаз, т.е. с участием адсорбированных веществ. Первые два типа реакций называют объемными, последний – поверхностными или гетерогенными.
В зависимости от соотношения между константой скорости реакции и коэффициентами массопереноса (например, коэффициентами масоотдачи) режим экстрагирования может быть диффузионным, переходным или кинетическим. Это относится к экстракции, как с объемными, так и с поверхностными реакциями. В кинетическом режиме объемная реакция протекает равномерно по всему объему реакционной фазы, и ее можно рассматривать как гомогенную, осуществляемую в открытом проточном реакторе, объем которого равен объему реакционной фазы. При этом скорость реакции не зависит ни от интенсивности перемешивания, ни от поверхности фазового контакта. Интенсификация возможна только за счет ускорения химической реакции (изменение температуры, введение катализаторов) или увеличением объема реакционной фазы.
В переходном режиме зона объемной реакции располагается возле границы раздела фаз. Ширина этой зоны, а вместе с ней и скорость экстракции, определяется как скоростью диффузии, так и скоростью реакции.
При диффузионном режиме зона реакции становится настолько узкой, что ее без существенной ошибки для расчетов можно отождествить с поверхностью, которая, в зависимости от типа реакции, либо совпадает с границей раздела фаз, либо «располагается» параллельно ей на некотором расстоянии. Скорость экстракции в этом режиме зависит от интенсивности перемешивания, поскольку от нее зависит и скорость переноса вещества в зону реакции, и площади межфазной поверхности.
Скорость установления равновесия при распределении вещества между водной и органической фазами зависит от скорости массопередачи внутри обеих фаз и через границу их раздела, а также от скорости химических реакции в каждой из фаз или на межфазной границе. В условиях интенсивного перемешивания в экстракционных аппаратах массопередача достаточно высока. В большинстве случаев то же можно сказать о скоростях гетерогенных химических реакций, протекающих в экстракционных системах. Например, равновесие при экстракции металлов аминами и сольватирующими экстрагентами устанавливается за несколько секунд. В общем случае время на установления экстракционного равновесия составляет 2–5 мин. В некоторых случаях низкая скорость экстракции объясняется не медленным образованием экстрагируемого соединения, а другими химическими реакциями, например, гидролизом или комплексообразованием в водной фазе, предшествующими экстракции.
Общее уравнение скорости экстракции, учитывающее диффузионные и химические сопротивления, описывается выражением:
j = (CR – CR*) / (1/вR + 1/  вE +1/k1) , (1)
вE +1/k1) , (1)
где CR – средняя концентрация распределяемого компонента в рафинате;
CR* – концентрация в объеме рафината, равновесная со средней концентрацией компонента в экстракте;
вR и вE – коэффициенты массопередачи в фазах;
 – коэффициент распределения элемента;
– коэффициент распределения элемента;
k1 – константа скорости прямой реакции (экстракции).
В зависимости от величин диффузионных – 1/вR, 1/(  вE) и химического – 1/k1 сопротивлений экстракция лимитируется массопередачей или химической реакцией. Скорость химической реакции в большей степени зависит от температуры, чем скорость массопереноса. Поэтому заметная зависимость коэффициента распределения от температуры служит косвенным указанием на то, что процесс экстракции лимитируется химической реакцией
вE) и химического – 1/k1 сопротивлений экстракция лимитируется массопередачей или химической реакцией. Скорость химической реакции в большей степени зависит от температуры, чем скорость массопереноса. Поэтому заметная зависимость коэффициента распределения от температуры служит косвенным указанием на то, что процесс экстракции лимитируется химической реакцией
Массопередача в системе жидкость – жидкость
Существуют два способа переноса массы – молекулярная и конвективная диффузия. Молекулярная диффузия может быть единственным способом массопередачи лишь при идеализированных условиях. Такие условия обычно реализуются при весьма малом времени контактирования фаз.
Второй способ массопередачи принципиально не может быть отделен от первого. При наличии движения фаз массопередача всегда осуществляется путем и молекулярного (диффузионного) и конвективного переноса. При этом преобладает тот или иной способ переноса в зависимости от расстояния до источника массы: на больших расстояниях определяющим является конвективный перенос, на малых – диффузионный.
Молекулярная диффузия в двухфазной системе
Изучение кинетики экстракции в условиях молекулярной диффузии является одним из наиболее корректных и информативных методов исследования реакций. Для мелких капель при наличии загрязнений поверхностно – активными веществами (ПАВ) молекулярная диффузия в дисперсной фазе может стать основным способом массопереноса.
Движущей силой диффузии является градиент химического потенциала, возникающий при отсутствии термодинамического равновесия в системе. Он уменьшается за счет перераспределения веществ между фазами. В результате возникает поток массы, плотность которого j в общем случае различна в разных направлениях.
Определение градиента химического потенциала (∆µ) – это очень сложная задача, поэтому расчет потоков массы производится в предположении, что движущей силой процесса диффузии является градиент концентрации (∆С).
Коэффициент пропорциональности между диффузионными потоками и концентрационной движущей силой есть коэффициент диффузии D. В случае изотермической однокомпонентной диффузии вещества А в среде второго компонента величина DА может быть определена из уравнения
j = – DА∆СА, (2)
где j - поток массы через единицу поверхности.
Уравнение (2) известно как первый закон Фика. Коэффициент DА правильнее называть коэффициентом взаимной диффузии, поскольку перемещение молекул растворенного вещества в бинарной смеси сопряжено со встречным движением молекул растворителя. Именно поэтому скорость переноса зависит от свойств обоих компонентов. Для растворов не существует точных методов расчета коэффициентов взаимодиффузии, чаще их находят экспериментальным путем.
Первым законом Фика удобно пользоваться при описании стационарных процессов переноса, когда скорость диффузии не изменяется во времени.
Для описания нестационарных процессов диффузии можно воспользоваться вторым законом Фика, который является следствием первого.
 , (3)
, (3)
где  - оператор Лапласа.
- оператор Лапласа.
Уравнение (3) справедливо, когда DА ≠ƒ (СА).
В случае одномерной нестационарной диффузии вдоль оси х уравнение (3) упрощается
 (4)
(4)
Если коэффициент диффузии зависит от концентрации, то
 (5)
(5)
Выражение для потока вещества плотностью j через границу раздела фаз имеет вид:
 , (6)
, (6)
где  - начальная концентрация распределяемого вещества в фазе 1;
- начальная концентрация распределяемого вещества в фазе 1;
DА1и DА2- коэффициенты диффузии в фазах 1 и 2;
ψА - коэффициент распределения компонента А;
τ - время.
Количество вещества (q), перенесенного через единицу площади поверхности за время τ, можно рассчитать по формуле:
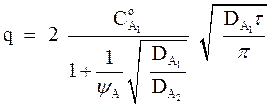 (7)
(7)
При ψА>>1 скорость экстракции перестает зависеть от коэффициента DА2и уравнение (7) запишется в виде
 (8)
(8)
Это означает, что массопередачу лимитирует диффузия в исчерпывающей фазе. При ψА<<1, наоборот, лимитирует диффузия в извлекающей фазе, т.к. в этом случае уравнение (7) запишется в виде:
 (9)
(9)
(в уравнении (7) при ψА<<1 в знаменателе единицей можно пренебречь, т.к. выражение  ).
).
Если предположить, что DА1 = DА2= D и ψА = 1, получим из уравнения (6) выражение, совпадающее с решением аналогичной задачи для гомогенной среды:
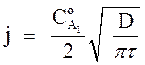 (10)
(10)
Исходя из уравнения (6), можно вывести известное правило аддитивности фазовых сопротивлений. Приняв коэффициенты массоотдачи в фазах равными
 и
и  , (11)
, (11)
получим:
 (12)
(12)
Числитель выражения (11) представляет собой общую концентрационную движущую силу, знаменатель – сумму фазовых сопротивлений. Если коэффициент массопередачи по фазе 1 обозначить К1, то
 (13)
(13)
Рассмотрим диффузию в обратном направлении (т.е. из фазы 2 в фазу 1) и получим:
 (14)
(14)
Подставляя значения β1 и β2, из уравнения (10) получим
 (15)
(15)
Таким образом, получим известное выражение, связывающее коэффициенты массоотдачи с коэффициентом массопередачи
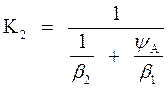 (16)
(16)
Закономерности переноса вещества в перемешиваемых двухфазных системах гораздо более сложны, чем в неперемешиваемых. При расчете скорости экстракции необходимо каждый раз учитывать конкретную гидродинамическую обстановку, т.е. необходимо знать распределение скоростей частиц жидкости в каждый момент времени в любой точке системы. Это распределение в общем случае нельзя найти в отрыве от рассмотрения процессов массопереноса, так как последние влияют на характер движения. Данное обстоятельство резко осложняет рачеты скорости экстракции, делая их недоступными для широкого круга специалистов.
Поэтому возникли два пути решения проблемы:
1) основан на создании относительно простых моделей массопередачи, которые продолжают использоваться и в настоящее время в инженерных расчетах;
2) принципиально иной путь описания массопередачи в двухфазных системах с подвижными границами основан на представлениях теории диффузионного пограничного слоя, которая позволяет с помощью обоснованных упрощений преодолеть математические трудности, связанные с решением уравнений конвективной диффузии и разумно подойти к описанию турбулентного режима массопередачи.
Самая простая модель известна под названием двухпленочной. Она основана на четырех допущениях:
1. предполагается, что изменение концентраций извлекаемого компонента происходит лишь в тонких пленках, непосредственно прилегающих к границе раздела фаз;
2. считается, что равновесие на межфазной границе устанавливается мгновенно;
3. предполагается линейность профиля концентраций в пленках, т.е. стационарность массопередачи;
4. состоит в требовании, чтобы массоперенос в пленках осуществлялся только путем молекулярной диффузии.
Поэтому массоотдачу в каждой из фаз можно описать с помощью известных формул типа ji = βiΔCi, где нижний индекс i указывает, что величина j, β, ΔC вблизи границы раздела фаз.
Массопередача при свободном движении единичных капель
Для расчета массопередачи при свободном движении единичных капель, когда сопротивления сплошной и дисперсной фаз соизмеримы, используется формула:
 , (17)
, (17)
где j - скорость экстракции через полную поверхность капли при больших
значениях числа Пекле (Ре>>1);
rк - радиус капли;
с и д - нижние индексы указывают соответственно на сплошную и
дисперсную фазы;
 .
.
В предельном случае, когда ψ>>1 и лимитирующей фазой является сплошная, уравнение (17) приводится к виду:
 (18)
(18)
Для описания переноса вещества в дисперсионной среде рекомендованы следующие выражения:
 ; (при Re<200); (19)
; (при Re<200); (19)
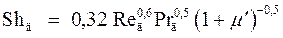 (при Re>200), (20)
(при Re>200), (20)
где числа Шервуда (Sh), Пекле (Pe) и Рейнольдса (Re) выражены через диаметр капли.
Массопередача в период формирования капель протекает более интенсивно, чем в период свободного движения. Экспериментальные результаты изучения кинетики массопередачи в период формирования капли обобщены уравнением:
 , (21)
, (21)
где G - количество экстрагируемого вещества, перенесенного за время τ;
γ - коэффициент, составляющий γ≈1;
p и n - числа, определяющие закон роста поверхности капли со
временем.
При лимитирующем сопротивлении дисперсной фазы степень извлечения ε за время τ может быть вычислена по формуле:
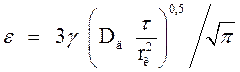 (22)
(22)
Для увеличения коэффициента массопередачи обычно одну из фаз диспергируют (обычно органическую – т.е. фазу экстрагента). Поэтому наибольший интерес для практики представляет массопередача при стесненном движении капель, так как во все современных экстракционных аппаратах с целью интенсификации массообмена применяют принудительное перемешивание, способствующее увеличению межфазной поверхности и повышению коэффициентов массопередачи.
Однако при строгом описании массопередачи в этих условиях затруднения очень велики. Поэтому к настоящему времени имеются лишь приближенные способы, а также эмпирические соотношения для расчета коэффициента массопередачи в сплошной (водной фазе). Скорость экстракции может быть найдена, если известна еще и межфазная поверхность. Для расчета ее используют многочисленные эмпирические уравнения.
При протекании химических реакций в экстракционных системах картина процесса усложняется. Однако если экстракция осуществляется в кинетическом режиме, обусловленном медленными реакциями в объеме какой-либо фазы, описание кинетики извлечения вещества резко упрощается. В этом случае диспергирование, коалесценция, стесненное движение капель, продольное перемешивание в аппаратах, адсорбция ПАВ и другие процессы, которые трудно учесть при расчете скорости экстракции, играют несущественную роль. При этом не нужно знать ни поверхности фазового контакта, ни коэффициентов массоотдачи. Однако такие случаи очень редки.
Адсорбция некоторых веществ на границе раздела фаз может приводить к образованию поверхностных слоев, резко изменяющих свойства границы раздела фаз и ее окрестностей. Важнейшим свойством таких слоев, издавна использующимися на практике, является их способность играть роль межфазных структурно-механических барьеров (СМБ), замедляющих коалесценцию капель и расслаивание эмульсий. В практике экстрагирования неорганических веществ также часто приходится сталкиваться с образованием относительно устойчивых эмульсий, что сильно вредит проведению непрерывных процессов. Это особенно характерно для экстракции многовалентных элементов, склонных к гидролизу и гидролитической ассоциации, а также растворов, содержащих взвеси, коллоидные частицы и высокомолекулярные ПАВ. Именно в этих случаях образуются межфазные пленки (СМБ), обладающие повышенной вязкостью или даже механической прочностью. Их толщина достигает 10-4см. Пленки оказывают сильное влияние на кинетику экстракции.
В случаях массопередачи с поверхностными реакциями образование СМБ радикальным образом влияет на кинетику. Это впервые продемонстрировано на примерах экстракции циркония из различных водных растворов в алкифосфорные кислоты. Массобмен в этих и подобных случаях характеризуется следующими особенностями:
1) резкими снижениями скорости экстракции металлов задолго до достижения равновесия, особенно при низких концентрациях кислоты в водной фазе; коэффициенты массопередачи при этом не зависят от интенсивности перемешивания;
2) уменьшением коэффициентов массопередачи, а иногда даже абсолютной скорости экстракции металлов, с ростом их концентрации в водной фазе;
3) существенной ролью эффектов обновления поверхности, выражающейся в увеличении коэффициентов массопередачи при разрушении плоской поверхности и переходе к эмульсионному режиму;
4) резким уменьшением скорости экстракции других ионов в присутствии соли металла, склонного к образованию межфазных пленок, и лишь незначительным уменьшением в этом случае коэффициентов массопередачи нейтральных молекул бензола, этанола, хлороформа, распределяющихся «физически».
Так как СМБ блокирует зону реакции, ее скорость существенно замедляется. Возникает дополнительное сопротивление, которое порой значительно превышает фазовые диффузионные сопротивления.
Известно, что скорость установления равновесия между двумя жидкими несмешивающимися фазами (водный раствор и органический экстрагент) определяется скоростью массопередачи и скоростью химической реакции. В условиях интенсивного перемешивания фаз в экстракторах массопередача протекает с высокой скоростью, а скорости химических реакций, протекающих в гидрометаллургии, обычно также высоки за исключением реакций, протекающих с образованием внутрикомплексных соединений или сольватов.
Лекция № 10
Практическое осуществление процесса экстракции
Способы осуществления экстракции
Периодическая экстракция представляет собой экстракцию вещества из одной фазы отдельными порциями свежего экстрагента. При достаточно высоких значениях коэффициента распределения однократная экстракция позволят количественно извлечь вещество в органическую фазу. Эффективность однократной экстракции можно характеризовать степенью извлечения, рассчитываемой по формуле:
 (1)
(1)
Если однократная экстракция не обеспечивает достаточной степени извлечения, то Е можно повысить за счёт увеличения V(O) или прибегая к многократной экстракции.
Часть вещества, оставшаяся в водной фазе после первой экстракции, будет равна:
 (2)
(2)
После любой n-кратной экстракции оставшуюся часть вещества в водной фазе можно рассчитать по формуле:
 (3)
(3)
Отсюда степень извлечения после n-кратной экстракции равна:
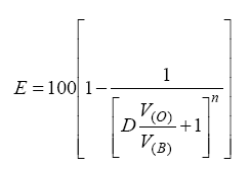 (4)
(4)
Вычисление числа ступеней экстракции для достижения заданной конечной концентрации экстрагируемого вещества осуществляют по формуле:
 (5)
(5)
Расчет распределения вещества в зависимости от числа экстракций показывает, что для достижения максимальной степени экстракции число последовательных экстракций может быть не более 5-6 при D=1.
Периодическую экстракцию преимущественно проводят в делительной воронке. В делительную воронку вводят водный раствор, содержащий экстрагируемое соединение, и органический растворитель, не смешивающийся с водной фазой. Затем воронку энергично встряхивают для обеспечивания хорошего контакта фаз. После встряхивания фазы разделяют.
Непрерывная экстракция – осуществляется при непрерывном и относительном перемещении двух фаз; одна из фаз, обычно водная, остаётся неподвижной.
Противоточная экстракция. Последовательность операций в противоточном распределении заключается в том, что верхняя, как правило, органическая фаза переносится последовательно через серию экстракционных трубок и в каждой из них контактирует со свежими порциями нижней водной фазы до установления равновесия. Таким образом, на каждой стадии происходит распределение веществ между свежими порциями обеих фаз. Процесс установления равновесия и переноса повторяют n раз.
Противоточную экстракцию применяют для разделения сложных смесей, а также для выделения малых количеств компонентов из больших объёмов исходного материала. Есть и другие способы осуществления противоточной экстракции.
Практическое осуществление экстракции.
Если коэффициент распределения и отношение объемов фаз достаточно велики, то иногда металл можно извлечь и очистить за одну или две-три периодические операции экстракции. В противном случае проводят несколько операций свежим органическим растворителем. Этап обработки раствора, содержащего экстрагируемое вещество, новой порцией экстрагента, называют экстракционной ступенью.
Для n ступеней экстракции справедливо следующие уравнение:
Cnвод = Cисхвод [Vвод / ( Vвод +  Vорг)] n , (6)
Vорг)] n , (6)
где Cnвод – концентрация вещества в водной фазе после n операций;
Cисхвод – исходная концентрация вещества в водной фазе;
Vвод и Vорг – объем фаз при каждой ступени экстракции;
 – коэффициент распределения.
– коэффициент распределения.
Анализ уравнения показывает, что наибольшее уменьшение концентрации металла в водной фазе достигается при большом значении n и малом Vорг (т.е при многоступенчатой экстракции малыми порциями экстрагента). Однако производить большое число последовательных операций свежим растворителем невыгодно, поэтому на практике обычно используют противоточную экстракцию.
При практическом осуществлении непрерывной противоточной экстракции важно определить число теоретических ступеней, необходимых для достижения заданных показателей, например степени извлечения. Число ступеней многоступенчатой противоточной экстракции можно определить графическим методом по изотерме экстракции (линия изменения концентрации компонентов в экстрагенте в зависимости от их концентраций в исходном растворе при равновесных условиях) и так называемой рабочей линии (рис. 1).
|
|

Рисунок 1 – Определение числа ступеней экстракции
Изотерма экстракции проходит через начало координат и определяется уравнением:
Y =  X, (7)
X, (7)
где  – коэффициент распределения вещества;
– коэффициент распределения вещества;
Y – концентрация извлекаемого вещества в равновесной органической фазе;
Х – концентрация извлекаемого вещества в равновесной водной фазе.
При  = const изотерма представлена прямой. В случае зависимости
= const изотерма представлена прямой. В случае зависимости  от концентрации вещества в водной фазе, изотерма криволинейна (рис. 37, линия ОА).
от концентрации вещества в водной фазе, изотерма криволинейна (рис. 37, линия ОА).
Рабочую линию строят от точки Xn (заданная концентрация вещества в водной фазе на выходе каскада), заканчивая ее в точке В, абсцисса которой Хо (концентрация вещества в исходном растворе на входе каскада), а ордината зависит от соотношения объемов потоков (наклон определяется отношением Vвод /Vорг). Действие одной ступени экстракции описывается линией ВВ'С, а после построения ломаной линии ВВ'СС'ДД'Хn определяется необходимое число теоретических ступеней. Учитывая, что на каждой реальной ступени равновесие не устанавливается до конца, принимают КПД ступени ~ 80 %, увеличивая число ступеней экстракции по сравнению с расчетным.
Некоторые примеры по концентрированию и разделению металлов экстракцией. Проявление индивидуальности веществ в отношении их растворимости в различных растворителях открывает широкие возможности для извлечения, концентрирования и разделения металлов экстракцией.
Экстракция в гидрометаллургии меди. В странах дальнего зарубежья наибольших успехов жидкостная экстракция достигла в гидрометаллургии меди. Экстракцию в технологии меди используют (см. рис. 2) на нескольких заводах в США и Африки (Замбия, ЮАР).

Рисунок 2 – Схема экстракционного извлечения меди
Медь из растворов, получаемых при выщелачивании бедных руд или отвалов (< 1 г/дм3 Сu), обычно цементируют железным скрапом. Недостаток этого процесса – расход серной кислоты на образование FeSO4. Кроме того, цементную медь в этом случае необходимо дополнительно очищать для получения товарного продукта.
Основное преимущество жидкостной экстракции по схеме выщелачивание – электролиз состоит в контроле содержания примесей. Органическая фаза выполняет роль буфера между выщелачиванием и электролизом, обеспечивая получение более чистой катодной меди. Так как примеси из выщелачивающего раствора не попадают в электролит, то в выщелачивающей цепочке можно допускать более высокое содержание примесей. Это в свою очередь позволяет уменьшить расход воды, что упрощает проблему сброса отходов.
Примером такого промышленного процесса является экстракция меди из кислых растворов (с содержанием меди 1–3 г/дм3) кучного выщелачивания окисленных медных руд с применением в качестве экстрагента Lix-64N с последующим электролитическим осаждением меди. Первый в мире завод по экстракции меди – «Блюберд» (США). Число ступеней экстракции соответственно 3 и 4, реэстракции – 2 и 3. Процесс включает три замкнутых цикла: оборот рафината на стадию кучного выщелачивания, оборот экстрагента и электролита.
Очистка хлорида сурьмы от мышьяка и других примесей.Очистка SbC13 основана на хорошей растворимости AsC13 и плохой SbC13 в керосине при нормальной температуре, повышенной растворимости SbC13 в горячем (90 оС) керосине и на нерастворимости в этом углеводороде хлоридов подавляющего большинства металлов, загрязняющих сурьму. Очистка сурьмы от примесей может быть осуществлена по следующей схеме:
– из раствора, насыщенного техническим SbC13, СаC12 и НC1, мышьяк и примеси извлекают керосином при нормальной температуре;
– из этого же раствора керосином при 100 оС экстрагируют SbC13;
– из керосиновой вытяжки сурьму реэкстрагируют водой.
Экстракционное разделение циркония и гафния. В качестве примера рассмотрим экстракционное разделение циркония и гафния трибутилфосфатом, используемое в промышленной практике. Трибутилфосфат экстрагирует цирконий и гафний из растворов оксихлоридов или нитратов этих элементов. Наиболее удобны для разделения растворы нитратов, содержащих свободную азотную кислоту. Как видно на рисунке 3, коэффициент распределения циркония (  Zr) выше, чем гафния при всех концентрациях азотной кислоты.
Zr) выше, чем гафния при всех концентрациях азотной кислоты.
Лучшая экстрагируемость циркония объясняется меньшей степенью диссоциации его нитрата. При повышении концентрации азотной кислоты степень диссоциации нитрата гафния сильно понижается. Поэтому с увеличением кислотности раствора коэффициент разделения в =  Zr /
Zr /  Hf падает с 12 (при 6 моль/дм3 HNO3) до 4 (при 9 моль/дм3 HNO3). Выгодно вести экстракцию из растворов с концентрацией кислоты 5–6 моль/дм3, когда коэффициент разделения велик.
Hf падает с 12 (при 6 моль/дм3 HNO3) до 4 (при 9 моль/дм3 HNO3). Выгодно вести экстракцию из растворов с концентрацией кислоты 5–6 моль/дм3, когда коэффициент разделения велик.
|
|
|
| |
| |

Рисунок 4 – Зависимость коэффициентов распределения циркония (1),
гафния (2) и их разделения (3) от концентрации азотной кислоты.
В процессе экстракции циркония протекает следующая реакция:
ZrO2+ + 2H+ + 4NO3- + 2ТБФ ↔ Zr(NO3)4 · 2ТБФ + H2O. (8)
Константа равновесия этой реакции
К = [Zr(NO3)4 · 2ТБФ]орг / [ZrO2+]вод[H+]2вод[NO3-]4вод[ТБФ]2ор. (9)
Отношение
[Zr(NO3)4 · 2ТБФ]орг / [ZrO2+]вод =  Zr , (10)
Zr , (10)
где  Zr – коэффициент распределения циркония. Отсюда
Zr – коэффициент распределения циркония. Отсюда
 Zr = К [H+]2вод[NO3-]4вод[ТБФ]2орг . (11)
Zr = К [H+]2вод[NO3-]4вод[ТБФ]2орг . (11)
Из уравнения следует, что экстракции способствует увеличение кислотности, концентрации нитрат-ионов и ТБФ. Экстракцию осуществляют раствором 40 %-ного ТБФ в n-гептане (С7Н16) в четырнадцатиступенчатом экстракторе типа смеситель-отстойник.
Исходный раствор содержит около 120 г/дм3 ZrO2, 5 моль/дм3 HNO3 и 2,4 % Hf (по отношению к цирконию). Цирконий и азотную кислоту реэкстрагируют из органической фазы водой. Для регенерации азотной кислоты водный раствор выпаривают досуха и улавливают пары азотной кислоты и оксиды азота. В результате экстракционного разделения получают циркониевый продукт с содержанием < 0,01 % Hf. Получаемый на выходе из экстракционной системы гафниевый рафинат содержит более 90 % Hf. При экстракции цирконий очищается не только от гафния, но и от ряда других примесей (Al, Ca, Fe, Mg, Si, Ti).
Экстракционное извлечение индия. Для экстракции индия из промышленных сернокислых растворов применяют ди-2-этилгексилфосфорную кислоту. Такой раствор реагента в керосине экстрагирует практически нацело индий из сернокислых растворов самой различной кислотности (коэффициент распределения индия при увеличении кислотности от 1 до 10 моль/дм3 уменьшается примерно от 4000 до 1000). В то же время сопутствующие индию элементы – такие, как цинк, кадмий, медь, никель, марганец, мышьяк, железо (II),– экстрагируются только из слабокислых растворов. Их коэффициенты распределения, достигающие 20–60 при рН 2,5–5, быстро уменьшаются с увеличением кислотности и равны 10-2–10-4 при рН < 0. Индий экстрагируется в виде комплекса In[Н(R2РО4)2]3. Совместно с ним экстрагируются лишь железо (III), олово, сурьма (III). Поэтому перед экстракцией железо должно быть восстановлено. В качестве реэкстрагента лучше всего брать НСl (8–10 моль/дм3).
Технологическая схема экстракционного извлечения индия из растворов показана на рисунке 5.

Рисунок 5 – Схема экстракционного извлечения индия из
сложного по составу раствора.
После экстракции (экстрагируют в несколько ступеней противоточным способом) органическую фазу промывают серной кислотой с целью удаления элементов, экстрагировавшихся вместе с индием в незначительных количествах. В результате реэкстракции получается солянокислый раствор, содержащий ~ 50 г/дм3 индия, из которого (после сульфидной очистки от примесей) индий выделяют цементацией на цинковых листах. В экстрагенте постепенно накапливается железо (III) вследствие неполной реэкстракции соляной кислотой. Его удаляют, промывая экстрагент раствором оксалата аммония с рН 4,5–5,5. Оксалат регенерируется после осаждения железа аммиаком. Экстракционный способ дает более высокое извлечение индия по сравнению с описанными ранее способами осаждения. Недостаток его – попадание органических веществ в цинковые растворы, что мешает электролизу цинка.
Лекция № 11
Аппаратурное оформление процессов экстракции
К настоящему времени создано множество различных более или менее удачных конструкций экстракционной аппаратуры. Аппараты для экстракции – экстракторы – должны удовлетворять следующим принципиальным требованиям:
- ускорять обмен между фазами, т.е. обеспечивать хороший контакт между органической и водной фазами;
- облегчать осуществление противотока двух фаз, одной по отношению к другой, с минимальным взаимным захватом;
- быть механически удобными и надежными для работы, обслуживания и ремонтов;
- быть компактными, высокопроизводительными, занимать возможно меньшие площади цехов;
- быть изготовленными из стойких материалов;
- быть относительно недорогими, по стоимости изготовления и при эксплуатации.
С каждым годом повышается потребность в экстракционном оборудовании. Увеличивается и требуемая производительность промышленных экстракторов. Если до 70-х годов прошлого века она не превышала 30-50 м3/час, то к настоящему времени уже превышает сотни м3/час, особенно при экстракции из рудных декантационных растворов. Наибольшее применение получили три основных типа экстракторов: роторно-дисковые, смесительно-отстойные с механическим перемешиванием фаз и центробежные.
Особое место занимают пульсационные экстракторы и их применение оправдано лишь в производствах, требующих дистанционного управления, и на объемах не выше 10 м3/час.
По характеру изменения состава жидких фаз экстракторы можно разделить на две группы: дифференциально-контактные аппараты, в которых происходит плавное изменение состава фаз вдоль его длины (высоты); ступенчатые экстракторы, в которых изменение состава фаз происходит скачкообразно (ступенчато) и в каждой ступени осуществляется перемешивание и разделение фаз.
Экстракторы обеих групп могут быть классифицированы по двум признакам: по роду сил, под действием которых осуществляется диспергирование одной фазы в другой (контакт между фазами возможен за счет собственной энергии потоков фаз – экстракторы без механических перемешивающих устройств или за счет подвода эне
|
из
5.00
|
Обсуждение в статье: Кинетика процессов экстракции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы



