 |
Главная |
Основные требования к экстрагентам
|
из
5.00
|
1) Хорошее расслаивание как при экстракции, так и при реэкстракции;
2) малая растворимость в водных растворах;
3) обратимость химической реакции между экстрагентом и компонентами водного раствора;
4) селективность экстрагента по отношению к извлекаемому компоненту;
5) высокая емкость экстрагентов (мг/г или мг-экв/г);
6) оптимальные плотность и вязкость экстрагента, достигаемые разбавлением с помощью органических растворителей;
7) достаточно высокое межфазовое натяжение на границе раздела фаз для ускорения коалесценции енсмешивающихся жидкостей при их отстаивании. Существенное влияние на него оказывают поверхностно-активные вещества;
8) устойчивость экстрагента к действию окислителей, нагревания или охлаждения;
9) экстрагент должен иметь низкое давление пара, что обеспечивает ведение процесса в открытой аппаратуре, и высокую температуру вспышки (в целях обеспечения пожаробезопасности процесса).
Лекция № 8
Методы исследования состава экстрагируемых соединений
Немаловажное значение для дальнейшей переработки имеет определение состава экстрагируемых комплексов. О механизме экстракции и составе экстрагируемых комплексов можно сделать достоверные заключения, лишь сопоставляя результаты, полученные различными независимыми методами. Для этой цепи используют химические, физико-химические и физические методы исследования.
К химическим методам относится метод насыщения, который заключается в определении на основе химического анализа отношения числа молекул экстрагента и экстрагируемого соединения при насыщении последним органической фазы (раствора экстрагента в разбавителе).
Среди физико-химических методов наиболее часто используют методсдвига равновесия (метод тангенса угла наклона) и метод изомолярных серий. Находят также применение кондуктометрический, криоскопический методы и метод Асмуса.
Метод насыщения. Из правила фаз следует, что если в водную фазу добавить распределяемое вещество до насыщения, т. е. до появления осадка, то для полученной трехфазной системы вариантность становится равной нулю.
В.В. Фомин подчеркнул, что в общем случае химический анализ полученной органической фазы не дает ответа на вопрос о составе соединений.
Например, при насыщении ТБФ нитратом циркония отношение мольных концентраций свидетельствует об образовании моносольвата, тогда как по результатам других методов в процессе образуется дисольват.
Другим ограничением метода является зависимость растворимости распределяемых веществ от температуры. При этом отношение мольных концентраций является дробным и также изменяется с температурой. Ниже приведены данные по насыщению ТБФ нитратом тория при различных температурах:
Температура, °С …………… 0 39 50 90 103 130
[ТБФ]: [Th(N03)4……………. 2,63 2,41 2,34 2,09 2,01 2,01
Видно, что лишь при температурах выше 100 °С отношение мольных концентраций ТБФ и нитрата тория остается постоянным и близким к 2. Однако и в этом случае вывод об образовании в системе дисольвата не противоречит существованию в системе тетра- и трисольватов, поскольку метод насыщения позволяет определить лишь минимальное сольватное число. Это же ограничение характерно и для определения q по фазовым диаграммам экстракционных систем.
В основе метода сдвига равновесия лежат приведенные выше зависимости коэффициента распределения от концентраций экстрагента, аниона, который входит в состав образующего соединения, ионов водорода и т.д. Наиболее часто определение состава сольватов проводят по билогарифмической зависимости коэффициента распределения от концентрации экстрагента методом сдвига равновесия. В одном из вариантов метода – методе разбавления – сольватное число определяется как тангенс угла наклона зависимости логарифма коэффициента распределения от логарифма концентрации свободного экстрагента. Метод можно использовать при низких концентрациях экстрагента в органической фазе, когда коэффициент активности (γорг ≈ 1) и при отсутствии полимеризации экстрагента в органической фазе. При этом используют «инертный» разбавитель.
При образовании извлекаемым веществом и экстрагентом лишь одного комплекса справедливо соотношение:
lg  = const + qlgCэ , (1)
= const + qlgCэ , (1)
где Cэ – исходная концентрация экстрагента; q – сольватное число.
Из уравнения видно, что сольватное число равно угловому коэффициенту зависимости lg  от lgCэ. Однако увеличение концентрации экстрагента часто сопровождается изменением углового коэффициента зависимости в этих координатах. Поэтому q, как правило, определяют при малых концентрациях, что не гарантирует получения истинных сольватных чисел применительно к неразбавленному экстрагенту.
от lgCэ. Однако увеличение концентрации экстрагента часто сопровождается изменением углового коэффициента зависимости в этих координатах. Поэтому q, как правило, определяют при малых концентрациях, что не гарантирует получения истинных сольватных чисел применительно к неразбавленному экстрагенту.
Заниженные дробные значения q могут быть обусловлены для гидратированных комплексов уменьшением гидратного числа с разбавлением. Уменьшение сольватных чисел металлгалогенидных комплексных кислот при разбавлении нейтральных экстрагентов связано с различием сольватации ионов, ионных пар и других ионных ассоциатов, образующихся при низких значениях диэлектрической проницаемости органической фазы.
Л. К. Чучалин и др. сформулировали следующие условия, при которых метод сдвига равновесия приводит к правильным результатам:
1) экстракция должна протекать с образованием сольватов постоянного состава (на это обстоятельство рапсе обратил внимание В. В. Фомин;
2) экстрагируемые соединения должны переходить в органическую фазу в молекулярной форме;
3) в процессе экстракции не должна протекать соэкстракция воды, молекулы экстрагируемых сольватов не должны обладать способностью к образованию с молекулами других компонентов связей типа водородных.
Несмотря на то, что большинство экстракционных систем не удовлетворяет этим условиям, уравнение (1) применяют для определения значений q наиболее часто.
Метод изомолярных серий Остромысленского-Джоба, применяемый для определения состава сольватов, заключается в изучении зависимости некоторого свойства системы (оптическая плотность, температура замерзания и др.), связанного с концентрацией образующегося соединения, от ее состава при постоянной сумме числа молей исходных веществ, но переменном количестве каждого из них. Составу сольвата отвечает максимальное значение определяемого свойства. Как и в случае метода сдвига равновесия, исследования проводят при низких концентрациях взаимодействующих компонентов, когда можно принять, что их коэффициенты активности равны единице.
Одним из вариантов метода изомолярных серий является метод Асмуса, согласно которому экстракцию металла осуществляют одним и тем же объемом органической фазы из серии водных растворов, которые имеют одинаковый объем, постоянную концентрацию иона металла и ионную силу. Перед разбавлением до одинакового объема в эти растворы прибавляют объем Vx раствора с известной концентрацией галогенид-иона. Далее определяют модуль оптической плотности
mА = А/ l, (2)
где А – оптическая плотность (найденная колориметрическим методом),
l – толщина кюветы с анализируемым раствором.
На основе экспериментальных данных строят зависимости 1/Vxр от mА , придавая р различные значения. Если р соответствует числу ионов х в экстрагируемом соединении, то получают прямую линию.
Следует учитывать, что методы насыщения, сдвига равновесия и изомолярных серий дают достаточно надежные результаты при образовании в системе только одного соединения.
Метод кондуктометрического титрования применим к экстрагентам с относительно высокой диэлектрической проницаемостью. В этом случае с достаточной точностью можно регистрировать изменение электропроводности органической фазы после добавления в водную фазу различного количества кислоты НХ или ее соли. Строится график зависимости электропроводности от количества прибавленного галогенид-иона. Излом на графике соответствует стехиометрическому составу экстрагирующихся соединений.
Криоскопический метод, впервые примененный в рассматриваемых целях В. В. Фоминым с сотрудниками, позволяет определять состав сольватов лишь в предельных случаях, когда экстрагируемое соединение не диссоциирует и не образует ассоциатов в органической фазе.
Известно, что для разбавленных растворов при криоскопии:
∆t = Кк· m , (3)
где ∆t – понижение температуры замерзания раствора по сравнению с температурой замерзания растворителя;
Кк – криоскопическая постоянная.
На основании измерения понижения температуры замерзания до экстракции (∆tо) и после нее (∆t) могут сделаны некоторые выводы о составе экстрагируемого соединения.
1. Если концентрация раствора не изменилась в процессе экстракции то ∆t = ∆tо. Следовательно, можно предполагать образование моносольвата.
2. Если ∆t < ∆tо , значит концентрация раствора в процессе экстракции уменьшилась. Значит две или больше число молекул экстрагента связываются при образовании одной молекулы комплекса. Число сольватации определяется:
q – 1 = (∆tо – ∆t) / Кк· m. (4)
3. Если ∆t > ∆tо, значит концентрация раствора увеличилась и извлечение происходит без связывания экстрагента (происходит «физическое распределение»).
Уравнение (2) применимо лишь при малых концентрациях растворов. При больших концентрациях следует применять другие, более точные уравнения. Некоторую неопределенность в результаты криоскопических измерений вносит распределение воды, поскольку в настоящее время трудно выделить долю криоскопически активной воды и, следовательно, точно определить понижение температуры замерзания растворов, обусловленное присутствием комплекса. Кроме того, метод применим лишь к экстрагентам, разбавленным «инертным» растворителем с удобной для исследования температурой замерзания (бензолом, циклогексаном и т. д.).
К физическим методам анализа, с помощью которых в совокупности с другими методами удается установить механизм экстракции элемента, относятся УФ-, ЯМР-, МАСС-, ИК- спектроскопии, ПМР и др. Для исследования состава экстрагируемых соединений используют так же методы комбинационного рассеивания света и протонного магнитного резонанса.
Важное место среди физических методов анализа занимает инфракрасная спектроскопия, позволяющая получить информацию о наличии групп и связей в молекуле экстрагируемого соединения и изменениях (сдвигах) полос поглощения, характерных для отдельных связей. Метод, в частности, позволяет выяснить, имеет ли место сольватный или гидратно-сольватный тип экстракции нейтральным экстрагентом.
По зависимости интегральной интенсивности резонанса свободной и связанной молекул экстрагента можно определить сольватные числа в разбавленных растворах методом ЯМР.
Определение степени гидратации
Катцин и Салливан предложили находить степень гидратации по тангенсу угла наклона зависимости общей концентрации воды в органической фазе (тв) от содержания извлеченного компонента. Построенные в этих координатах зависимости обычно нелинейны и имеют минимум в области достаточно разбавленных растворов. Это связано с изменением равновесной активности воды и соответствующим уменьшением количества «свободной» воды.
Так, при оценке концентрации воды, не входящей в гидратную оболочку извлекаемых веществ в фазе экстрагента, принято, что присутствие извлекаемого компонента существенно не влияет на взаимодействие между экстрагентом и водой. При этом приближении концентрацию гидратной воды определяют по разности аналитической концентрации воды 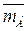 и ее растворимости в чистом экстрагенте
и ее растворимости в чистом экстрагенте  0 (αВ) при равновесной αВ. В соответствии с уравнением
0 (αВ) при равновесной αВ. В соответствии с уравнением
 =
=  0 (aB) + h
0 (aB) + h 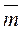 .(5)
.(5)
h определяют по тангенсу угла наклона зависимости количество гидратной воды от концентрации извлеченного вещества.
Растворимость воды в чистом экстрагенте при различных ее активностях чаще всего определяют экспериментально. А.М. Розен и др. показали возможность расчета 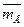 0 (aB) по данным о взаимной растворимости воды и экстрагента с использованием полуэмпирического уравнения Скетчарда.
0 (aB) по данным о взаимной растворимости воды и экстрагента с использованием полуэмпирического уравнения Скетчарда.
В координатах концентрация гидратной воды –  при малой концентрации распределяемого вещества часто наблюдаются нелинейные зависимости, что объясняют недостаточно высокой точностью определения концентрации «свободной» воды. Допущения, положенные в основу определения концентрации «свободной» воды в растворе, становятся более корректными при переходе от неразбавленных экстрагентов к их растворам в «инертных» разбавителях.
при малой концентрации распределяемого вещества часто наблюдаются нелинейные зависимости, что объясняют недостаточно высокой точностью определения концентрации «свободной» воды. Допущения, положенные в основу определения концентрации «свободной» воды в растворе, становятся более корректными при переходе от неразбавленных экстрагентов к их растворам в «инертных» разбавителях.
Если предполагают образование гидратов постоянного состава, то степень гидратации обычно считают постоянной, не зависящей от равновесной активности воды. В. В. Фомин подчеркнул, что, как правило, отсутствуют объяснения наблюдаемых на опыте дробных значений h, не принимается во внимание изменение растворимости воды в органической фазе, связанное с понижением концентрации «свободного» экстрагента. Анализ многочисленных экспериментальных данных показал, что в общем случае h является функцией равновесной активности воды в системе.
Лекция № 9
|
из
5.00
|
Обсуждение в статье: Основные требования к экстрагентам |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

