 |
Главная |
Занятие 4. Растворы. Приготовление раствора тетрабората натрия по точной навеске
|
из
5.00
|
Содержание занятия:
1. Расчет массы навески кристаллогидрата Na2B4O7 · 10H2O
2. Взвешивание навески Na2B4O7 на технических и аналитических весах.
3. Приготовление раствора тетрабората натрия.
4. Расчет точной молярной концентрации эквивалента полученного раствора Na2B4O7
Вопросы для подготовки и выполнения лабораторной работы.
1. Классификация методов количественного анализа (химические и физико-химические);
2. Теоретические основы объемного анализа;
3. Основные понятия объемного анализа. Классификация методов объемного анализа.
4. Посуда, применяемая в объемном анализе.
Практическая часть:
Цель: Приготовить раствор Na2B4O7 объемом V=100мл (0,1л) с молярной концентрацией эквивалента С(1/2Na2B4O7)=0,1 моль/л по точной навеске кристаллогидрата состава Na2B4O7 · 10H2O
I. Расчет массы навески кристаллогидрата, необходимой для приготовления необходимого раствора:
m(Na2B4O7·10H2O) = С(1/2Na2B4O7) · М (1/2Na2B4O7·10H2O) · V(р-ра)=0,1 моль/л · 191г/моль · 0,1л = 1,91г.
II. Взвешивание на технических и аналитических весах навески:
Сначала можно взвесить бюкс без вещества и с веществом на технохимических весах. Затем бюкс с навеской переносят на чашку аналитических весов и взвешивают его с точностью до 0,0001 г. Вещество из бюкса осторожно пересыпают через сухую воронку в мерную колбу. Бюкс с остатками вещества снова взвешивают на аналитических весах, и количество вещества, перенесенного в колбу, находят по разности. Не вынимая воронку, ополаскивают ее подогретой дистиллированной водой и наполняют колбу на 2/3 объема. Взбалтывают содержимое колбы до полного растворения вещества.
III. Приготовление раствора тетрабората натрия: пересыпают кристаллогидрат через воронку в мерную колбу на 100 мл, затем оставляют на некоторое время, чтобы раствор охладился до комнатной температуры. После этого наполняют колбу водой до метки и перемешивают.
Раствор переливают в чистую сухую склянку, закрывают пробкой и наклеивают этикетку. По величине навески рассчитывают точную концентрацию полученного раствора.
IV. По точной навеске кристаллогидрата рассчитывают массу вещества Na2B4O7, перешедшего в раствор по схеме:
масса навески х(г)

V. Рассчитать точную молярную концентрацию эквивалента полученного раствора по формуле:
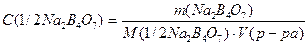
VI. Полученный результат показывают преподавателю.
Занятие 5, 6. Энергетика химических процессов.
Актуальность темы
Все термодинамические процессы, связанные с переходом одного вида энергии в другой, подчинены I закону термодинамики – закону сохранения энергии. Однако важно знать не только энергетику, но и направление и глубину протекания того или иного процесса.
Направленность и пределы протекания самопроизвольных процессов изучает II закон термодинамики.
Мотивация
Живые системы подчиняются всем основным законам природы. К ним полностью применим закон сохранения и превращения энергии, а также II начало термодинамики. Трансформацию энергии в организме изучает биоэнергетика. Живые системы являются открытыми, гетерогенными системами. В процессе жизнедеятельности организм поглощает в виде пищи разнообразные вещества, ассимилирует и преобразует их, а затем в процессе диссимиляции разрушает и удаляет их в виде отработанных продуктов во внешнюю среду. Термодинамические особенности открытых систем объясняют устойчивость живого организма и его способность в течение многих лет сохранять на определенном уровне энтропию, энергию Гиббса и относительное постоянство внутренней среды, называемое в биологии гомеостазом.
Знание общих законов термодинамики позволяет врачу осуществить научный подход к пониманию энергетики биохимических реакций в организме, процессов эмбриогенеза, регенерации тканей, старения и возможности регулировать эти процессы проведением профилактических и лечебных мероприятий.
Цель занятия:
приобрести навыки термодинамических расчетов. На конкретных примерах решать вопрос о возможности самопроизвольного протекания реакции в заданных условиях (из анализа величин «G, «Н, «S и их зависимость от температуры), а также определения условий, при которых наступает термодинамическое равновесие в системе.
Студент должен знать:
· формулировки и математическое выражение II закона термодинамики;
· зависимость энтропии от различных факторов;
· убыль энергии Гиббса как реакционной способности химической системы;
· связь между изменением энергии Гиббса и константой равновесия.
Студент должен уметь:
· формулировать и применять I и II законы термодинамики к различным физико-химическим процессам в термодинамических системах;
· правильно характеризовать и объяснять взаимосвязь следующих понятий: открытая, закрытая, изолированная системы; внутренняя энергия U, работа А, теплота Q, энтальпия Н, энтропия S, энергия Гиббса G;
· рассчитывать энергетические характеристики химических и физических процессов;
· определять направление самопроизвольного протекания процессов в организме.
|
из
5.00
|
Обсуждение в статье: Занятие 4. Растворы. Приготовление раствора тетрабората натрия по точной навеске |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

