 |
Главная |
Занятие 7, 8. Кинетика, катализ, химическое равновесие
|
из
5.00
|
Актуальность темы
Практически все биохимические реакции, протекающие в живых организмах, являющиеся каталитическими, т.е. осуществляются в присутствии биокатализаторов-ферментов. Все ферментативные биохимические реакции подчиняются законам кинетики в приложении к биосистемам.
В основе кинетики различных биологических процессов, направлении биохимических реакций, биоэлектрических явлений, проницаемости биологических мембран, лежит химическая кинетика – учение о скорости химических реакций.
Методы кинетики биологических процессов широко применяются при изучении физико-химических механизмов возникновения патологических состояний организмов, динамики ферментативных процессов (нормы и патологии), в фармакокинетике, иммунокинетике.
Понимание основных закономерностей химической кинетики, катализа и состояния химического равновесия необходимо для изучения бионеорганической, биологической и токсикологической химии, фармакологии, действия на живой организм различных лекарственных препаратов.
Цель занятия
Получить системные знания о закономерностях протекания химических и биохимических реакций, влияния различных факторов на скорости реакции.
Студент должен знать:
· классификацию химических реакций;
· влияние концентрации веществ на скорость химических реакций (закон действия масс);
· влияние температуры (закон Вант-Гоффа);
· понятие об энергии активации, энергетическом барьере, уравнение Аррениуса;
· теории гомо- и гетерогенного катализа;
· условия протекания обратимых и необратимых реакций;
· направления смещения равновесия в соответствии с принципом Ле-Шателье.
Студент должен уметь:
· прогнозировать направление смещения равновесия;
· оценить влияние концентрации и температуры на скорости химических реакций;
· проводить расчеты изменения скорости реакции и времени ее осуществления при изменяющихся параметрах.
Необходимый исходный уровень знаний и умений
Знать примеры и уметь составлять уравнения реакций: экзо- и эндотермических, обратимых и необратимых.
Содержание занятия:
1. Обсуждение теоретических вопросов;
2. Решение задач по теме занятия;
3. Контрольная работа «Кинетика, химическое равновесие»
Вопросы для обсуждения на занятии:
1. Понятие средней и истинной скорости реакции. Зависимость скорости реакции от концентрации.
2. Зависимость скорости реакции от температуры. Энергия активации. Уравнение Аррениуса.
3. Молекулярность и порядок реакции.
4. Катализ. Влияние катализатора на скорость химических реакций. Особенности биокатализаторов.
5. Обратимые химические реакции, химическое равновесие, смещение химического равновесия.
Лабораторная работа №1. Зависимость скорости реакции от концентрации (реакция Ландольта)
Опыт 1.
1-й стакан
К 20 мл раствора А быстро при перемешивании добавляем 20 мл раствора В и засекаем время секундомером от момента сливания до изменения окраски.
2-й стакан
К 20 мл раствора А добавляем 10 мл дистиллированной воды и быстро при перемешивании вливаем 10 мл раствора В. Фиксируют время до появления окраски.
3-й стакан
К 20 мл раствора А добавляем 15 мл Н2О и 5 мл раствора В. Определяют время протекания реакции.
Раствор А – кислый раствор сульфита натрия с добавлением крахмала.
Раствор В – содержит йодат калия.
2 KIO3 + 5 Na2SO3 + H2SO4 = 5 Na2SO4 + K2SO4 + I2 + H2O
Результаты сводят в таблицу и затем строят график зависимости υ – скорости реакции (ось ординат) от С – концентрации (ось абсцисс) KIO3.
| № п/п | Объем, мл | Концентрация
С= 
| Промежуток времени от начала отсчета до помутнения t, сек | Скорость реакции
υ = 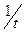
| ||
| а Na2SO3 | б H2O | в KIO3 | ||||
| - | 
|
Делают вывод о зависимости времени реакции от концентрации реагирующих веществ.
Опыт 2
В трех пронумерованных стаканчиках готовят растворы различной концентрации:
1-й стакан – 10 мл раствора Na2S2O3 + 20 мл H2O;
2-й стакан – 20 мл раствора Na2S2O3 + 10 мл H2O;
3-й стакан – 30 мл раствора Na2S2O3.
В стакан 1-й вливают цилиндром 10 мл раствора H2SO4, перемешивают. В момент сливания растворов включают секундомер и отсчитывают время до появления легкого помутнения.
Аналогично поступают со стаканами 2 и 3-м.
Na2S2O3 + H2SO4 = Н2S2O3 + Na2SO4; Н2S2O3 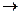 S
S  + H2SO3.
+ H2SO3.
Результаты вносят в таблицу и затем строят график зависимости υ – скорости реакции (ось ординат) от С – концентрации (ось абсцисс) Na2S2O3.
| № п/п | Объем, мл | Концентрация
С= 
| Промежуток времени от начала отсчета до помутнения t, сек | Скорость реакции
υ = 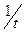
| ||
| а Na2S2O3 | б H2O | в H2SO4 | ||||
| - | 
|
Делают вывод о зависимости скорости реакции от концентрации реагирующих веществ.
|
из
5.00
|
Обсуждение в статье: Занятие 7, 8. Кинетика, катализ, химическое равновесие |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

