 |
Главная |
Решение задач по теме занятий
|
из
5.00
|
1. Теплота реакции взаимодействия гидроксида алюминия Al(OH)3 с соляной кислотой составляет 234,2 кДж/моль. Сколько выделится теплоты, если для реакции взято 7,02 г Al(OH)3?
2. При сгорании 1 кг бензола выделяется 41990 кДж. Определите теплоту сгорания бензола.
3. Теплоты образования оксида и диоксида азота равны соответственно 21,6 и 643 ккал/моль. Вычислите тепловой эффект реакции 2NO+O2= 2NO2 (в кДж/моль).
4. Теплоты сгорания ацетилена и этана равны соответственно 1300 и 1540 кДж/моль. Чему равна теплота гидрирования ацетилена до этана?
5. Вычислите теплоту образования кристаллогидрата СаСl2 · 6Н2О из безводной соли и воды по следующим данным: теплота растворения кристаллогидрата –18,02 кДж/моль; теплота растворения безводной соли 72,9 кДж/моль.
6. Теплота растворения Na2SO3 равна 11,3 кДж/моль; теплота гидратации этой соли до Na2SO3·7Н2О составляет 58,1 кДж/моль. Вычислите теплоту растворения кристаллогидрата.
7. Теплота сгорания глюкозы равна 2816 кДж/моль; теплота сгорания этилового спирта равна 1236 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы:
С6Н12О6= 2С2Н5ОН(ж)+ 2СО2(г)+ Q
8. Теплота сгорания углеводов и белков в организме человека составляет 4,1 ккал/г, жиров – 9,3 ккал/г. Среднесуточная потребность в белках, жирах и углеводах для студентов мужчин составляет соответственно 113, 106 и 451 г, для студентов женщин 96, 90 и 383 г. Какова суточная потребность студентов в энергии?
9. На испарение 1 моля воды требуется 40,7 кДж. Сколько теплоты будет потеряно за день при выделении через кожу 800 г воды? Сколько граммов углеводов должно быть окислено для получения этого количества теплоты?
10. В 100 г трески в среднем содержится 11,6 г белков и 0,3 г жиров. Рассчитайте калорийность порции трески массой 220 г.
11. При взаимодействии газообразного метана и сероводорода образуется сероуглерод CS2(г) и водород. Определите изменение энтальпии реакции; напишите термохимическое уравнение.
12. При взаимодействии трех моль оксида азота (I) с аммиаком образуются пары воды и азота. Тепловой эффект реакции равен (ΔН=-877,76 кДж). Напишите термохимическое уравнение реакции и вычислите изменение энтальпии образования N2O(г).
13. Тепловые эффекты растворения MgSO4 и МgSO4 . 7Н2О в воде соответственно равны: -84,8 кДж/моль и 15,9 кДж/моль. Какова теплота гидратации при переходе MgSO4 в МgSO4 . 7Н2О?
14. Рассчитайте энтальпию образования Н2О2(ж), исходя из теплового эффекта реакции:
Н2О2(ж)= Н2О(ж)+ 1/2О2(г) ΔН= -98,03 кДж/моль
15. При получении одного моль эквивалента гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,63 кДж теплоты. Напишите термохимическое уравнение и вычислите энтальпию образования оксида кальция.
16. Энтальпия реакции нейтрализации азотной кислоты гидроксидом калия равна –57,3 кДж/моль. Вычислите энтальпию процесса, протекающего при добавлении к 100 мл раствора азотной кислоты с С=1 моль/л 150 мл раствора гидроксида калия с С=0,9 моль/л?
17. Энергетическую ценность пищевого продукта оценивают его теплотой сгорания (калорийностью) и выражают в кДж/г (ккал/г). Вычислите калорийность (в кДж/г):
а) жира тристеарина (С57Н110О6), если энтальпия сгорания жира равна (-37760 кДж/моль);
б) сахарозы (С12Н22О11), если энтальпия сгорания сахарозы равна (-5653 кДж/моль).
18. Реакция горения этилового спирта выражается термохимическим уравнением:
С2Н5ОН(ж)+ 3О2(г)= 2СО2(г)+ 3Н2О(ж). ΔН=?
Вычислите энтальпию реакции, если известно, что энтальпия парообразования С2Н5ОН(ж)=+38,58 кДж/моль и известны энтальпии образования С2Н5ОН(г), СО2(г), Н2О(ж).
19. В некоторых микроорганизмах при анаэробной (в отсутствии воздуха) ферментации протекает следующая реакция:
С6Н12О6 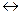 2 С3Н6О3
2 С3Н6О3
глюкоза молочная кислота
Вычислите тепловой эффект этой реакции, если известны тепловые эффекты следующих процессов:
С6Н12О6(г) + 6О2(г) 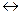 6СО2(г) + 6Н2О(ж) ΔН= -2808 кДж/моль
6СО2(г) + 6Н2О(ж) ΔН= -2808 кДж/моль
С3Н6О3(ж) + 3О2(г) 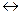 3СО2(г) + 3Н2О(ж) ΔН= -1369 кДж/моль
3СО2(г) + 3Н2О(ж) ΔН= -1369 кДж/моль
20. Вычислите энтальпию образования метана, исходя из следующих термохимических уравнений:
а) Н2(г) + 1/2О2(г)=Н2О(ж) ΔН1= -285684 кДж
б) С(к) + О2(г)=СО2(г) ΔН2= -393,51 кДж
в) СН4(г) + 2О2(г)=2Н2О(ж) + СО2(г) ΔН3= -890,31 кДж
21. Вычислить энтальпию растворения лития в воде, используя данные по гидратированным ионам:
2Li(к) + 2Н2О(ж)= 2Li+ + 2ОН- + Н2(г)
25. Какие из следующих оксидов могут быть восстановлены алюмотермически при 298 К:
а) CaO б) Fe2O3 в) РвО?
26. Какие из следующих оксидов могут быть восстановлены водородом до свободного металла при 298 К:
а) ZnO б) FeO в) Al2O3?
27. Определите устойчивость металлического кальция в атмосфере углекислого газа при 298К.
28. Пероксид водорода, образующийся в организме, разлагается под действием каталазы крови на воду и кислород. Возможен ли этот процесс в отсутствии каталазы? (p=1 атм., t=25˚ С)?
29. Какой из 2х путей превращения глюкозы в организме сопровождается
большим изменением энергии Гиббса:
а) С6Н12О6(р-р) = 2СО2(г)+ 2С2Н5ОН(ж)
б) С6Н12О6(р-р) = 2С3Н6О3(р-р)
30. Могут ли существовать друг с другом сернистый газ и сероводород при t=25˚С?
31. Покажите с помощью термодинамического расчета, что процесс перехода
НС-СООН НООС-СН
║ → ║
НС-СООН НС-СООН
а) малеиновая кислота б) фумаровая кислота
может осуществляться самопроизвольно в организме человека (t=37оС), если известно:
∆Но298(кДж/моль): а) -791 б) –312
∆Sо(кДж/моль•к): а) =160 б) 166
Термодинамические константы некоторых веществ
| Вещество | ΔН0298 кДж/моль | ΔG0 298 кДж/моль | S0 298 Дж/моль*К |
| AgCI(к) AL2O3(к) BaCО3(к) ВеСО3(к) С(алмаз, к) С(графит, к) СН4(г) С2Н2(г) С2Н4(г) СН3ОН(г) С2Н5ОН(г) CS2(г) CS2(ж) СО(г) СО2(г) СаСО3(к) СаО(к) Са(ОН)2(к) НСI(г) НСI(ж) FeO(к) Fe2O3(к) Fe3O4(к) Н2(г) N2(г) NН3(г) NН4CI(к) NO(г) NO2(г) O2(г) ОН –(р) Н+(р) Н2О(г) Н2О(ж) PCI3(г) PCI5(г) PОCI3(ж) S(к, ромб.) Н2S(г) С6Н6(ж) С2Н6(г) Сахароза С12Н22О11(т) Li+ (р) | -127,1 -1676 -1219 -982 1,828 -74,86 226,75 52,28 -201,17 -235,31 115,27 88,7 -110,52 -393,51 -1206,9 -635,5 -986,6 -91,8 -166,9 -264,8 -822,2 -1117,1 -46,19 -314,2 90,25 -230,19 -241,82 -285,83 -287,02 -366,0 -597,1 -21 -210,9 -846,67 -2220,9 -278,5 | -109,8 -1582 -944,7 2,833 -50,79 -137,14 -394,38 -1128,8 -604,2 -896,8 -94,79 -131,2 -244,3 -740,3 -1014,2 -16,71 -203,2 86,58 51,5 -157,42 -228,61 -237,24 -260,5 -305,4 -521,3 -33,8 | 96,11 50,92 67,29 2,36 5,74 186,19 200,82 219,45 239,780 278,03 237,82 151,0 197,54 213,68 92,9 39,7 76,1 186,8 56,5 60,75 87,4 146,2 130,52 199,9 192,6 95,8 210,6 240,2 205,04 -10,86 188,72 70,08 311,7 364,5 222,5 31,9 205,7 359,8 |
|
из
5.00
|
Обсуждение в статье: Решение задач по теме занятий |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

