 |
Главная |
Лабораторная работа № 4. Обратимость смещения химического равновесия
|
из
5.00
|
В демонстрационную пробирку наливают 20 мл раствора K2CrO4, по каплям добавляют раствор серной кислоты и наблюдают изменение окраски. Затем в этот же раствор по капля добавляют раствор щелочи и отмечают восстановление прежней окраски.
В растворах, содержащих хромовую кислоту Н2CrO4, двухромовую кислоту Н2Cr2O7 или их соли, существует равновесие.
2 CrO42- + 2H+ 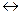 Cr2O72- + Н2О
Cr2O72- + Н2О
хромат-ион дихромат-ион
(желтый) (оранжевый)
Изменение концентрации ионов водорода в растворе вызывает смещение равновесия и изменения окраски.
Делают вывод.
Виды контроля знаний и умений студентов на занятии
1. Устный опрос по вопросам домашнего задания.
2. Решение задач по теме.
3. Проверка протоколов оформления демонстрационных опытов.
Задачи для решения на занятиях и самостоятельного решения
1. В системе 2SO2(г) + О2(г) 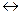 2SO3(г) концентрацию оксида серы (IV) увеличили с 0,3 до 0,6 моль/л, а концентрацию кислорода с 0,6 до 1,8 моль/л. Во сколько раз возрастает скорость прямой реакции?
2SO3(г) концентрацию оксида серы (IV) увеличили с 0,3 до 0,6 моль/л, а концентрацию кислорода с 0,6 до 1,8 моль/л. Во сколько раз возрастает скорость прямой реакции?
2. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO(г) + О2(г) 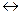 2NO2(г) возросла в 103 раз?
2NO2(г) возросла в 103 раз?
3. Разложение N2O при высоких температурах протекает по уравнению:
2 N2O(г) 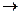 2 N2(г) + О2(г)
2 N2(г) + О2(г)
Константа скорости данной реакции равна 5 . 10 –4 моль/л при 900˚С. Начальная концентрация N2O = 3,2 моль/л. Определить скорость реакции при заданной температуре в начальный момент времени и в тот момент, когда разложилось 25 % N2O.
4. Скорость реакции увеличится в 4 раза при повышении температуры на 10˚С. Во сколько раз возрастет скорость реакции при повышении температуры от 45˚С до 75˚С?
5. Допустимый срок хранения лекарственного вещества при комнатной температуре (20˚С) 3 года. В процессе ускоренного определения его стабильности при 70˚С, оно потеряло свои свойства через 40 суток. Соответствует ли лекарственное вещество предъявленным требованиям, если температурный коэффициент скорости равен 2?
6. Реакция при t=20˚С протекает за 12 минут 48 секунд. На сколько градусов необходимо повысить температуру системы для завершения этой реакции за 48 секунд (температурный коэффициент равен 2)?
7. Реакция идет по уравнению N2(г) + О2(г) 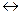 2NО(г). Концентрации исходных веществ до начала реакции были (моль/л): [N2] = 0,049; [О2] = 0,01. Вычислить концентрацию этих веществ в момент, когда [NО] стала равной 0,005.
2NО(г). Концентрации исходных веществ до начала реакции были (моль/л): [N2] = 0,049; [О2] = 0,01. Вычислить концентрацию этих веществ в момент, когда [NО] стала равной 0,005.
8. Реакция идет по уравнению: N2(г) + 3Н2(г) 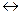 2NH3(г). Концентрации участвующих в ней веществ были (моль/л): [N2] = 0,80; [Н2] = 1,5; [NН3] = 0,10. Вычислить концентрацию водорода и аммиака, когда [N2] стала равной 0,50 моль/л.
2NH3(г). Концентрации участвующих в ней веществ были (моль/л): [N2] = 0,80; [Н2] = 1,5; [NН3] = 0,10. Вычислить концентрацию водорода и аммиака, когда [N2] стала равной 0,50 моль/л.
9. Вычислить равновесные концентрации Н2 и I2, если известно, что их начальные концентрации были равны 0,1 и 0,2 моль/л, а равновесная концентрация HI равна 0,1 моль/л. Вычислить константу равновесия в данных условиях.
10. В реакторе объемом 10 л содержится 5,6 г С2Н4, 150 г С2Н6 и водород. Константа равновесия реакции Н2(г) + С2Н4(г) ↔ С2Н6(г), выраженная через молярные концентрации, равна 50. Рассчитайте массу водорода.
11. При увеличении температуры от 10 до 50оС скорость реакции увеличилась в 16 раз. Определите её температурный коэффициент.
12. Константа равновесия реакции СН3СООН+С2Н5ОН↔ СН3СООС2Н5+Н2О равна 4. Вычислите равновесные концентрации всех компонентов системы, если начальные концентрации СН3СООН и спирта равны 2 моль/л и 1 моль/л соответственно.
13. В сосуд объемом 0,5 литров было помещено моль Н2 и 0,5 моль N2. При некоторой температуре к моменту равновесия образовалось 0,02 моль NН3. Вычислите константу равновесия.
14. Определите направление смещения равновесия следующих обратимых реакций:
а) 2SO2+O2↔2SO3+192,7 кДж
б) N2O4↔2NO2- 54,47 кДж
15. В каком направлении сместится равновесие следующих обратимых реакций:
а) С+Н2О↔СО+Н2 – 129,9 кДж
б) N2+3Н2↔2NH3+92,2 кДж
при повышении давления; при повышении температуры? Как при 

 этом будут изменяться концентрации компонентов каждой системы?
этом будут изменяться концентрации компонентов каждой системы?
16. Как изменить температуру, давление и концентрации компонентов, чтобы увеличить выход хлора в реакции
4НCl +O2↔2H2O+2Cl2+113,3 кДж
|
из
5.00
|
Обсуждение в статье: Лабораторная работа № 4. Обратимость смещения химического равновесия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

