 |
Главная |
Электрические моменты диполей молекул
|
из
5.00
|
(дипольный момент) m
| Молекула | m, D | Молекула | m, D |
| H2O | 1,84 | NF3 | 0,20 |
| H2S | 0,94 | NH3 | 1,48 |
| CS2 | 0,00 | PH3 | 0,58 |
| BF3 | 0,00 | AsH3 | 0,13 |
Таблица П6
Константы диссоциации некоторых электролитов
в водных растворах при 25 оС
| Электролит | Ступень диссоциации | Кд | Электролит | Ступень диссоциации | Кд | |
| H2O | 1,8 · 10–16 | H2SO4 | I II | 1,0 · 103 1,2 · 10–2 | ||
| HCN | 7,2 · 10–10 | |||||
| CH3COOH | 1,85 · 10–5 | NaOH | 0,6 · 101 | |||
| H2CO3 | I II | 4,3 · 10–7 5,6 · 10-11 | NH4OH | 1,79 · 10–5 | ||
| Zn(OH)2 | I II | 4,4 · 10–5 1,5 · 10–9 | ||||
| H2S | I II | 5,7 · 10-8 1,2 · 10–15 | ||||
| Cu(OH)2 | II | 3,4 · 10–7 | ||||
| H2SO4 | I II | 1,7 · 10–2 6,2 · 10–8 | Al(OH)3 | III | 8,0 · 10–10 | |
| Cr(OH)3 | III | 1,0 · 10–10 | ||||
| H2SiO3 | I II | 1,0 · 10–10 1,0 · 10–12 | Fe(OH)3 | I II | 5,0 · 10–10 3,0 · 10–12 | |
| HNO2 | 4,6 · 10–4 | Sn(OH)2 | II | 1,0 · 10–12 | ||
| HCl | 1,0 · 107 | Cd(OH)2 | I II | 3,0 · 10–5 4,0 · 10–7 | ||
| HBr | 1,0 · 109 | |||||
| HNO3 | 0,37 · 101 |
Таблица П7
Растворимость кислот, оснований и солей в воде
| Ка- тионы | Анионы | |||||||||||||||
| OH- | Cl- | Br- | I- | S2- | SO32- | SO42- | NO3- | PO43- | CO32- | SiO32- | CH3COO- | |||||
| H+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | |||||
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Х | Р | ||||
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ||||
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ||||
| Cu2+ | Н | Р | Р | Х | Н | Х | Р | Р | Н | Х | – | Р | ||||
| Ag+ | Х | Н | Н | Н | Н | Н | М | Р | Н | Н | Х | Р | ||||
| Mg2+ | Н | Р | Р | Р | – | Н | Р | Р | Н | Н | – | Р | ||||
| Ca2+ | М | Р | Р | Р | – | Н | М | Р | Н | Н | Н | Р | ||||
| Ba2+ | Р | Р | Р | Р | – | Н | Н | Р | Н | Н | Н | Р | ||||
| Zn2+ | Н | Р | Р | Р | Н | Н | Р | Р | Н | Н | Н | Р | ||||
| Al3+ | Н | Р | Р | Р | – | Х | Р | Р | Н | З | – | М | ||||
| Sn2+ | Н | Р | Р | М | Н | Х | Р | – | Н | Х | – | Р | ||||
| Pb2+ | Н | М | М | Н | Н | Н | Н | Р | Н | Н | – | Р | ||||
| Cr3+ | Н | Р | Р | Р | – | Х | Р | Р | Н | Х | – | Р | ||||
| Mn2+ | Н | Р | Р | Р | Н | Н | Р | Р | Н | Н | – | Р | ||||
| Fe2+ | Н | Р | Р | Р | Н | Н | Р | Р | Н | Н | – | Р | ||||
| Fe3+ | Н | Р | Р | Х | – | Х | Р | Р | Н | Х | – | Р | ||||
| Co2+ | Н | Р | Р | Р | Н | Н | Р | Р | Н | Н | – | Р | ||||
| Ni2+ | Н | Р | Р | Р | Н | Н | Р | Р | Н | Н | – | Р | ||||
| Cd2+ | Н | Р | Р | Р | Н | Н | Р | Р | Н | Н | Н | Р | ||||
Условные обозначения:
Р – растворимые (более 10г на 1л воды);
М – малорастворимые (от 10 до 0,1л в 1л воды);
Н – нерастворимые (менее 0,1г в 1л воды);
Х – вещество не существует;
– вещество выделяется в виде газов или разлагается с выделением газа;
прочерк – вещество разлагается водой.
Таблица П8
Произведение растворимости малорастворимых электролитов
| Электролит | ПР | Электролит | ПР |
| AgBr | 4,4 · 10–13 | HgS | 4,0 · 10–53 |
| AgCl | 1,56 · 10–10 | MnCO3 | 1,8 · 10–11 |
| AgI | 9,7 · 10–17 | MnS | 1,4 · 10–15 |
| Ag2S | 1,6 · 10–49 | NiS | 9,3 · 10-22 |
| CdS | 1,0 · 10–29 | PbCl2 | 2,4 · 10–4 |
| CuCO3 | 2,5 · 10–10 | PbSO4 | 2,2 · 10–8 |
| CuS | 3,2 · 10–38 | SnS | 1,0 · 10–28 |
| FeS | 5,0 · 10–18 |
Таблица П9
Стандартные электродные потенциалы металлов ( 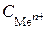 = 1 моль/л, t = 25 оC)
= 1 моль/л, t = 25 оC)
| Электродная система | jo, B | Электродная система | jo, B |
| Li+|Li | –3,05 | Ni2+|Ni | –0,25 |
| K+|K | –2,92 | Sn2+|Sn | –0,14 |
| Cs+|Cs | –2,92 | Pd2+|Pd | –0,13 |
| Ba2+|Ba | –2,91 | Fe3+|Fe | –0,04 |
| Ca2+|Ca | –2,87 | 2H+|H2 | 0,00 |
| Na+|Na | –2,71 | Sn4+|Sn | +0,01 |
| Mg2+|Mg | –2,36 | Bi3+|Bi | +0,22 |
| Be2+|Be | –1.85 | Cu2+|Cu | +0,34 |
| Al3+|Al | –1,66 | Cu+|Cu | +0,52 |
| Ti2+|Ti | –1,63 | Hg2+|Hg | +0,79 |
| Mn2+|Mn | –1,18 | Ag+|Ag | +0,80 |
| Zn2+|Zn | –0,76 | Hg2+|Hg | +0,85 |
| Cr3+|Cr | –0,74 | Pd2+|Pd | +0,99 |
| Fe2+|Fe | –0,44 | Pt2+|Pt | +1,19 |
| Cd2+|Cd | –0,40 | Au3+|Au | +1,50 |
| Co2+|Co | –0,28 | Au+|Au | +1,69 |
Таблица П10
Потенциалы водородного и кислородного электродов
при различных условиях (t = 25 оС)
| Среда концентрация H+ и OH– | Парциальные давления | |||
| водорода | кислорода | |||
| 101,325 кПа= = 1 атм (стандартное) | 5 · 10–5 кПа = = 5 · 10–7 атм (воздух) | 101,325 кПа = = 1 атм (стандартное) | 5 · 10–5 кПа = = 5 · 10–7 атм (воздух) | |
 , В , В
|  , B , B
| |||
| Кислая [H+] = 1 pH = 0 | 0,000 | +0,186 | +1,229 | +1,180 |
| Нейтральная [H+]=[OH–]=10–7 pH = 7 | –0,414 | –0,228 | +0,815 | +0,805 |
| Щелочная [OH+] = 1 pH = 14 | –0,828 | –0,641 | +0,401 | +0,391 |
Таблица П11
Перенапряжение выделения водорода 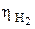 и кислорода
и кислорода 
на различных металлах при t = 25 оС и i = 10 A/м2
| Металл | 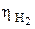
| 
| Металл | 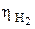
| 
|
| Pb | 1,23 | 0,69 | Cu | 0,48 | 0,40 |
| Hg | 1,07 | – | Ti | 0,40 | – |
| Cd | 1,05 | 0,90 | Fe | 0,36 | 0,30 |
| Zn | 0,83 | – | Ni | 0,30 | 0,70 |
| Al | 0,70 | – | Co | 0,20 | 0,24 |
| Sb | 0,67 | – | Pd | 0,15 | 0,94 |
| Ag | 0,65 | 0,50 | W | 0,13 | – |
| Графит | 0,65 | 1,10 | Pt (гладкая) | 0,07 | 1,18 |
| Sn | 0,63 | – | Au | 0,04 | 1,34 |
| Mn | 0,50 | – | Pt(платини- рованная) | 0,00 | 0,70 |
| Bi | 0,48 | – |
Таблица П12
Стандартные электродные потенциалы
Некоторых окислительно-восстановительных и газовых
электродов при t = 25 оС
| Электродная система | jо, В | Электродная система | jо, В |
| S | S– | –0,51 | Br2 | 2Br – | +1,065 |
| Sn4+ | Sn2+ | +0,15 | NO3– | N2O | +1,116 |
| SO42– | SO2 | +0,17 | NO3– | N2 | +1,246 |
| SO42– | H2S | +0,31 | Cr2O72– | 2Cr3+ | +1,33 |
| I2 | 2I – | +0,53 | Cl2 | 2Cl – | +1,36 |
| NO3– | NO2 | +0,755 | MnO4– | Mn2+ | +1,51 |
| Fe3+ | Fe2+ | +0,77 | S2O82– | 2SO42– | +2,01 |
| NO3– | NH4+ | +0,87 | F2 | 2F – | +2,87 |
| NO3– | NO | +0,957 |
|
из
5.00
|
Обсуждение в статье: Электрические моменты диполей молекул |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

