 |
Главная |
КЛАССИФИКАЦИЯ ФАЗОВЫХ ПЕРЕХОДОВ Эренфеста
|
из
5.00
|
Все многообразие фазовых переходов согласно классификации Эренфеста можно разделить на два основных типа - фазовые переходы 1-го и 2-го рода.
Равновесная температура (или давление) фазового перехода соответствует равенству свободных энергий Гиббса обеих фаз, т.е.
∆G = ∆H – T∆S = 0
Поэтому фазовое превращение не может сопровождаться скачком на зависимости свободной энергии от температуры (давления). Согласно определению Эренфеста, при фазовом переходе первого рода претерпевают скачок первые производные энергии Гиббса (G = U - TS + pV) по температуре и давлению, т.е. объем:
V = ∂G/∂p
и энтропия:
S = - ∂G/∂Т
так как термодинамический потенциал G меняется непрерывно при фазовом переходе при этом выделяется или поглощается теплота превращения:
Q = ∆U
Обычно фазовые переходы первого рода легко регистрируются экспериментально. Скачкообразное изменение объема в точке фазового перехода отвечает изменению кристаллической структуры, поэтому наблюдается рентгенографически. Также изменение объема регистрируется дилатометрически, а иногда и путем визуальных наблюдений. Так, например, изменение объема при превращении тетрагональной модификации ZrO2 в моноклинную вызывает растрескивание материала. Изменение объема сопровождается изменением энтальпии Н. Последнее можно обнаружить методом дифференциально-термического анализа (ДТА). Выделение или поглощение теплоты при температуре фазового перехода 1 рода фиксируется на кривых ДТА в виде эндотермических или экзотермических эффектов. Прямое измерение изменения энтропии проводить менее удобно, тем не менее, о существовании скачка энтропии можно логически заключить по наличию тех же пиков на кривых ДТА. Поскольку в точке фазового перехода ∆G = 0, то
∆S = ∆Н/Т
В случае же переходов типа порядок - беспорядок зафиксировать превращение можно рентгенографически.
При фазовых переходах 2-го рода термодинамический потенциал G, а также объем и энтропия меняются непрерывно, т. е. теплота при переходе не выделяется и не поглощается. Скачком меняются вторые производные термодинамического потенциала: теплоемкость:
CP = T(∂S/∂Т) = –T(∂2G/∂Т2)
коэффициент сжимаемости:
χ = – (1/V) (∂V/∂p) = – (1/V) (∂2G/∂p2)
коэффициент теплового расширения:
α = (1/V) (∂V/∂T) = (1/V) (∂2G/∂p∂T)
При переходах 1-го рода эти величины также могут меняться скачкообразно.
Принципиально можно определить и фазовые переходы более высоких порядков по скачкам производных энергии Гиббса более высоких порядков.
Экспериментально обнаружить фазовые переходы второго рода несколько сложнее, чем фазовые переходы первого рода, поскольку в этом случае изменения, происходящие в системе, обычно выражены гораздо слабее. Наиболее пригоден в этих целях калориметрический метод определения теплоемкости. При приближении к температуре фазового перехода Тс теплоемкость обычно возрастает, а в точке фазового перехода Тс претерпевает скачок.
Ниже приведены температурные зависимости: различных термодинамических функций при фазовых переходах. Предположим, что, энтальпия и энтропия фазы не зависят от температуры (рис. а,б), соответственно, с ростом температуры величина TS, линейно уменьшается (рис. в). (На практике, однако, строгого постоянства при изменении температуры, как правило, не наблюдается). На рис. г изображен случай, когда энтропия фазы 1 заметно меняется с температурой, особенно в области высоких температур. Такой ход изменения энтропии характерен для фаз, претерпевающих с ростом температуры разупорядочение; тогда произведение TS уменьшается гораздо быстрее с повышением температуры, чем по линейному закону (рис. д). Для большинства веществ приведенные на рис.ад схемы в целом правильно отражают реальные зависимости термодинамических функций от температуры. Поэтому свободная энергия фазы 1 должна непрерывно уменьшаться с ростом температуры (рис. е). Еще раз отметим, что каждая из фаз характеризуется собственной зависимостью G от Т. По определению фаза термодинамически устойчивая при данном наборе внешних параметров, характеризуется более низкими значениями величины свободной энергии G. Таким образом, фаза I (см. рисунок ж ниже) более стабильна при температурах ниже Тс, а фаза II ‑ при температурах выше Тс. Обе кривые G(T) пересекаются в точке равновесного фазового превращения, т. е. при Тс, где GI = GII. Значения энтропии фаз I и II определяются из наклона зависимостей G(T), так как dG/dT = ‑ S. Следовательно, фаза II имеет более высокую энтропию, чем фаза I (‑TSII < ‑TSI). Из уравнения (1.35) следует, что фаза II должна также иметь более высокую энтальпию, т. е. HI < HII. В общем случае, фаза, устойчивая при низких температурах, характеризуется более низкими значениями энтальпии и энтропии. На рис. з, и имеются скачки на зависимостях Н(Т) и S(T) в точке Тс, так как, хотя ∆G = 0, изменения энтальпий и энтропии отличны от нуля (∆H = T∆S ≠ 0). Это характерно для фазовых переходов первого рода. При протекании превращения должна выделяться скрытая: теплота фазового перехода ∆H. Фазовые переходы сопровождаются появлением на кривых ДТА при нагревании образцов эндотермических эффектов, а при охлаждении ‑ экзотермических эффектов.
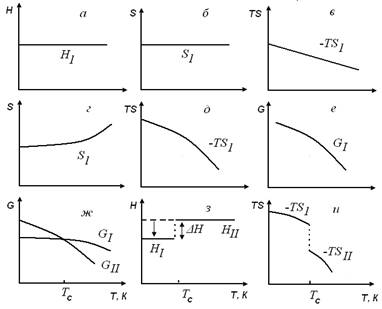
Зависимость термодинамических свойств фаз
от температуры (а ‑ е) и изменение этих свойств
в точке фазового перехода первого рода (ж ‑ и)
В случае фазового перехода первого рода кривые G(T) обеих фаз пересекаются (рис. ж). При фазовых переходах второго рода такого пересечения может и не быть, а графическое и термодинамическое представление фазовых превращений несколько более сложное. Поскольку речь идет о фазовом переходе второго рода, то энтропия системы не претерпевает скачка в точке Тс, и, следовательно, наклон кривых G(T) (dG/dT = – S) для обеих фаз I и II должен быть одинаков при этой температуре. Попытки представить это графически приведены на рис. а, б. Ситуация, изображенная; на рис. а, удовлетворительна с той точки зрения, что касательные кривых I и II при температуре Тс параллельны и совпадают (следовательно, ∆S = SII - SI = 0); однако не выдерживает критики то, что фаза II во всем интервале температур характеризуется более низкими значениями свободной энергии, и, следовательно, невозможно ожидать обратимого фазового превращения! Эта проблема может быть частично решена, если изобразить ход кривых G(T) так, как это сделано на рис. б. Для того чтобы кривые G(T) обеих фаз в области температур перехода совпадали, одна из них или обе вместе должны быть несколько искривлены (т. е. кривая зависимости G(T) на этом участке должна менять свой наклон). Поскольку зависимости G(T) фаз I и II не зависят друг от друга, то, видимо, необходимо предположить, что искривление одной из кривых происходит именно в области температур фазового превращения.
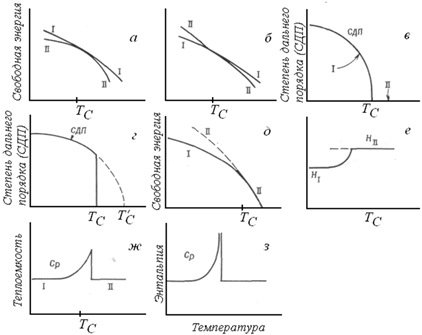
Термодинамические свойства фаз, претерпевающих
фазовые переходы первого и второго рода
Попытаемся на конкретном примере проследить и представить графически изменение термодинамических свойств в ходе фазового перехода второго рода. Многие переходы типа порядок – беспорядок относятся к фазовым переходам второго рода. Рассмотрим сплав АxВy, который ниже некоторой температуры Тс находится в упорядоченном состоянии, а выше этой температуры ‑ в разупорядоченном. Говорят, что при температурах ниже Тс в системе существует определенный дальний порядок, если он проявляется, например, в том, что атомы А предпочтительно занимают в кристаллической решетке позиции одного и того же сорта. При абсолютном нуле сплав может быть полностью упорядочен, т. е. степень дальнего порядка (СДП) максимальна. С ростом температуры начинается разупорядочение сплава: атомы начинают обмениваться своими позициями, СДП уменьшается. Этот процесс протекает с нарастающей скоростью, и в области температуры Тс дальний порядок исчезает (рис. 1.3, в). Выше Тс в системе сохраняется лишь некоторый ближний порядок. Под ближним порядком понимают такую ситуацию, когда каждый отдельный атом А окружен атомами В, и наоборот. Однако размеры такой упорядоченной области невелики. Степень разупорядочения системы может быть охарактеризована с помощью энтропии. Можно показать, что, хотя в интервале температур от О К до Тс энтропия заметно растет, на температурной зависимости этой величины отсутствуют скачки. Такие переходы можно рассматривать как фазовые переходы второго рода.
Рассмотрим форму кривых G(T) для упорядоченной (I) и неупорядоченной (II) фаз. Схематически они представлены на рис. 1.3, д. Штриховая линия, продолженная в область низких температур, относится к разупорядоченной модификации, которая существует в виде переохлажденной фазы ниже Тс. Однако получить перегретую фазу (т. е. перегреть фазу I выше Тс) невозможно, так как превращение фазы I в фазу II ‑ непрерывный процесс, начинающийся при абсолютном нуле и заканчивающийся при Тс. Температура Тс ‑ верхняя температурная граница существования фазы I; в этом смысле она аналогична критической точке, например, на диаграмме состояния воды в области равновесия жидкая вода ‑ пар. Согласно термодинамической теории фазовых переходов, развитой Тицца, переход второго рода эквивалентен существованию критической точки. Принципиальное отличие между рис. 1.3, д, б состоит в том, что если переохладить фазу II можно в обоих случаях, то перегреть фазу I в случае, изображенном на рис. 1.3, д, невозможно.
Лекция 4
|
из
5.00
|
Обсуждение в статье: КЛАССИФИКАЦИЯ ФАЗОВЫХ ПЕРЕХОДОВ Эренфеста |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

