 |
Главная |
Построение ДИАГРАММы СОСТОЯНИЯ
|
из
5.00
|
Для простоты рассмотрим систему А — В, в которой оба металла имеют одну и ту же кристаллическую структуру и образуют между собой непрерывные ряды жидких и твердых растворов. При температуре Т1, когда все сплавы этой системы находятся в жидком состоянии, кривые зависимости свободной энергии жидких и твердых растворов от состава показаны на рис. 1.7. При любом составе свободная энергия минимальна для жидкого состояния.
При понижении температуры разница в значениях свободных энергий для жидких и твердых растворов любого состава уменьшится. В конце концов, при температуре Т2 – температуре плавления чистого компонента А ‑ кривые коснутся, т. е. при этой температуре твердая и жидкая фаза компонента А находятся в равновесии, или имеют одну и ту же свободную энергию.
Дальнейшее понижение температуры до Т3 приведет к тому, что кривые свободных энергий пересекутся. Сплавы, имеющие составы от чистого А до XS, имеют минимальные значения свободных энергий, если существуют в виде твердых растворов компонента В в А. Аналогично сплавы, находящиеся в интервале составов между чистым компонентом В и двойным сплавом XL имеют минимальные значения свободной энергии, если существуют как жидкие растворы компонента А в компоненте В. Любой сплав, расположенный между точками XS и XL, будет иметь самые низкие значения свободной энергии, если он существует как смесь твердого раствора состава XS и жидкого раствора состава XL. Можно сказать, что при температуре Т3 твердая фаза определенного состава (XS) находится в равновесии с жидкой фазой также определенного состава (XL). Пока температура не меняется, составы равновесных твердой и жидкой фаз также остаются неизменными.
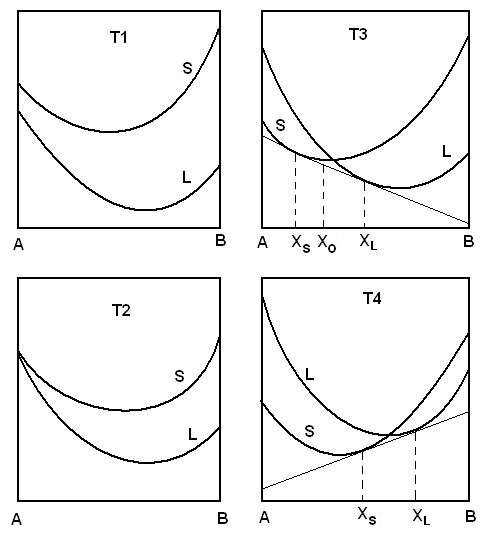
Рис. 1.7. Концентрационные зависимости энергии Гиббса
в двойной системе при температурах Т1, Т2, Т3, Т4
Дальнейшее понижение температуры до Т4 приведет к такому взаимному расположению кривых свободных энергий, что точка их пересечения Х будет перемещаться вправо; это сопровождается соответствующим сдвигом в том же направлении общей касательной, которая определяет составы жидкой и твердой фаз находящихся в равновесии друг с другом.
В результате дальнейшего понижения температуры перемещение кривых свободных энергий относительно друг друга приведет к тому, они сойдутся в одной точке, лежащей на ординате и соответствующей чистому компоненту В. Как и в случае чистого компонента А температура, при которой это произойдет, отвечает температуре плавления или кристаллизации компонента В, т. е. температуре при которой жидкая и твердая фаза находятся в равновесии. В конце концов, наступит положение, при котором кривая свободной энергии твердых растворов окажется ниже кривой свободной энергии жидких растворов, т. е. при этой и всех более низких температурах рассматриваемая система существует как взаимные твердые растворы компонентов А и В друг в друге. Если составы твердой и жидкой фаз, находящихся в равновесии друг с другом при различных температурах нанести на диаграмму в координатах состав ‑ температура получается фазовая, или равновесная, диаграмма состояния, которая обобщает все сведения, вытекающие из проведенного выше анализа кривых свободной энергии (рис. 1.8).

Рис. 1.8. Равновесная диаграмма состояния, соответствующая концентрационным зависимостям свободной энергии на рисунках
Если имеется возможность нескольких фазовых равновесий (рис. 1.9), то устойчивыми будут те из них, общие касательные которых, лежащие в своих двухфазных областях, проходят ниже остальных.
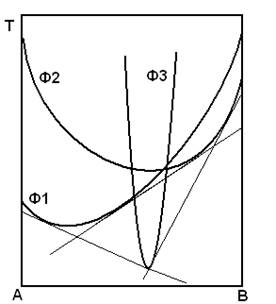
Рис. 1.9. Стабильные и метастабильные равновесия
Поэтому в случае, изображенном на рис. 1.9, стабильными будут равновесия Ф1 — Ф3 и Ф3 — Ф2, а равновесие между Ф1 и Ф2 может реализоваться только как метастабильное, если по каким-либо причинам оно устанавливается значительно быстрее, чем равновесия с участием фазы Ф3. Подобные ситуации возникают, например, при быстром охлаждении металлических расплавов.
Лекция 9
СПИНОДАЛЬНЫЙ РАСПАД
Вернемся к классификации фазовых превращений, предложенной Гиббсом, а именно вспомним флуктуации второго типа, представляющие небольшие изменения в больших объемах, которые характеризуют гомогенные превращения. Наибольший интерес представляют реакции расслоения растворов, находящихся в состоянии нестабильного равновесия, что характерно для фаз, состав которых находится в окрестностях максимума свободной энергии. В этом случае любая концентрационная флуктуация будет сопровождаться понижением свободной энергии, а значит усиливаться, т.е. система будет расслаиваться самопроизвольно по всему объему. Этот процесс носит название спинодального распада. Кроме спинодального распада, к гомогенным реакциям относятся некоторые процессы упорядочения.
Хотя из двойных диаграмм состояния следует только несколько потенциальных примеров равновесного спинодального распада в металлах, имеются многочисленные метастабильные реакции, которые могут проходить по непрерывному механизму.
При приближении к абсолютному нулю взаимная растворимость компонентов стремится к нулю, поскольку по теореме Нернста при T → 0, S → 0. Если энергия смешения атомов положительна UAB < ½(UAA + UBB), следовательно, взаимодействие атомов одного и того же элемента сильнее, чем взаимодействие разноименных атомов, значит при снижении температуры будет происходить самопроизвольный распад исходного твердого раствора на два твердых раствора разной концентрации. Чем больше положительная энергия смешения, тем выше температура распада. В огбратном случае, если энергия смешения атомов отрицательна UAB > ½(UAA + UBB), при охлаждении, вследствие уменьшения энтропии, будет происходить упорядочение.
Диффузионный поток при спинодальном распаде направлен от низких концентраций к высоким (в отличие от обычных диффузионных процессов), т.е. в сторону, противоположную градиенту концентрации. Такая диффузия называется восходящей и характеризуется отрицательным коэффициентом диффузии.
Спинодальный распад возможен только, если концентрационные флуктуации приводят к снижению свободной энергии системы, т.е. в окрестностях максимума энергии Гиббса (d2G/dС2>0) между точками перегиба (d2G/dС2=0). В области, где d2G/dС2 >0, превращение происходит только за счет роста зародышей (т.е. состояние является метастабильным) посредством нормальной диффузии, т.к. Малые концентрационные флуктуации приводят к росту энергии Гиббса системы. Т.е. область спинодального распада ограничена составами, для которых d2G/dС2=0 (точками перегиба на зависимости энергии Гиббса от состава). Если значения составов, для которых d2G/dx2 = 0 при данной температуре, нанести на равновесную диаграмму состояния, получается кривая, называемая спинодалью или спинодальной кривой. При переходе через эту кривую кинетика превращения резко меняется.
Таким образом, на диаграмме состояния можно выделить две области внутри двухфазной: центральную, находящуюся внутри спинодальной кривой (в этой области возможет спинодальный распад) и область между спинодальной кривой и пределом растворимости, где распад может протекать только за счет зародышеобразования. Сплавы, находящиеся в области температур и составов под спинодальной кривой распадаются намного быстрее сплавов, находящихся в области, где d2G/dС2 > 0.
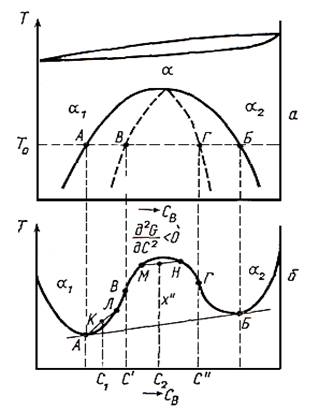
Рис. 10.1. Расслоение твердого раствора: а ‑ диаграмма состояния системы с расслоением, б ‑ изменение термодинамического потенциала расслаивающегося раствора в зависимости от состава
В наших рассуждениях не учитывалась упругая энергия при флуктуации, по-видимому, упругая энергия и обеспечивает некоторую устойчивость твердого раствора при пониженных температурах. Наличие напряжений приводит к сдвигу области спинодального распада к более низким температурам. Кривая, учитывающая упругую энергию при превращении, называется «когерентной» спинодалью.

Рис. 10,2. Область спинодального распада на фазовой диаграмме:
1 ‑ «химическая» спинодаль, 2 ‑ «когерентная» спинодаль
Различие между спинодальным распадом и обычным зарождением проиллюстрировано на рисунке. При зарождении образуется зародыш равновесного состава размера не меньше критического, который растет за счет нормальной диффузии. При спинодальном распаде в твердом растворе возникают флуктуационные волны концентрации. Длина такой волны определяется температурой распада сплава и составляет несколько десятков или сотен ангстрем. Возрастание амплитуды волны может происходить до полного расслоения твердого раствора.

Рис. Изменение концентрации твердого раствора
при образовании зародышей и при спинодальном распаде
Лекция 6
|
из
5.00
|
Обсуждение в статье: Построение ДИАГРАММы СОСТОЯНИЯ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

