 |
Главная |
ЗАВИСИМОСТЬ ЭНЕРГИИ ГИББСА ФАЗЫ ОТ СОСТаВА
|
из
5.00
|
Как было показано ранее, свободная энергия однородной системы является функцией температуры, давления и состава. Так что свободную энергию конденсированной фазы при заданных температуре и давлении можно представить в виде графика зависимости от состава фазы.
Каждая фаза имеет самостоятельную зависимость энергии Гиббса от состава, т.е. изображается на графике "G — концентрация" отдельной кривой.Общей закономерностью этих кривых является наличие минимума и их поведение вблизи чистых компонентов. Вид кривой зависимости свободной энергии от состава будет коррелировать с видом кривой зависимости энтропии смешения от состава с той лишь разницей, что максимуму энтропии будет соответствовать минимум свободной энергии. Пересечение этих кривых с осями ординат чистых компонентов будет происходить, вообще говоря, на разной высоте, поскольку различные фазы компонентов имеют разную устойчивость, за исключением частных случаев, когда условия (температура и давление) соответствуют фазовому переходу у одного из компонентов (рис. 1.6).

Концентрационная зависимость энергии Гиббса в двойной системе АВ при температуре фазового перехода
Можно выделить два варианта поведения кривой свободной энергии в зависимости от энтальпии Н=U+PV. Характер зависимости энтальпии от концентрации определяется характером изменения внутренней энергии (член PV можно не учитывать). Суммарная внутренняя энергия (U) зависит от энергии связи между соседними атомами: одно- (UАА, UВВ) или разнородными (UАВ). Полная энтальпия составляет:
H = NAAHAA + NBBHBB + NABHAB
где NAA HAA NBB HBB NAB HAB – число связей соответственно АА, ВВ и АВ и значения их энтальпий. Критической оказывается величина
Н0 = HAB – 0.5(HAA + HBB),
которая называется обменной энергией. Если Н0 = 0, раствор идеальный, т.е. при смешении не происходит ни увеличения ни уменьшения внутренней энергии (“механическое” смешение), зависимость Н от концентрации раствора — прямая линия. Если Н0 < 0 при смешении – образовании двух пар АВ из пар АА и ВВ - энергия раствора уменьшается, т. е. На зависимости Н от С имеется минимум. Если же Н0 > 0 при смешении — образовании пар АВ - энергия раствора увеличивается, зависимость Н от концентрации имеет максимум.
Таким образом, при сложении зависимостей H и -TS получаются два принципиально разных варианта зависимости свободной энергии: зависимость имеет один глубокий минимум или на зависимости имеются перегибы с двумя минимумами и максимумом.

а) Н0 = 0, б) Н0 < 0, в) Н0 > 0
Зависимости свободной энергии Гиббса от концентрации твердого раствора при различном характере зависимости энтальпии смешения
Как было сказано ранее, условием равновесия нескольких фаз в многокомпонентной системе помимо равенства температуры и давления является равенство химических потенциалов:
µiα = µiβ = …
При неравенстве химических потенциалов компоненты системы перераспределяются (компонент переходит в ту фазу, где его химический потенциал меньше) — при этом изменяется их концентрация в каждой из фаз и, соответственно, химический потенциал, т.к. химический потенциал – функция температуры, давления и концентрации. Переход происходит до тех пор пока химические потенциалы каждого компонента в каждой фазе не уравняются
µαA(P,T,CαA) = µβA(P,T,CβA).
Химический потенциал µA = (∂G/∂СA)P,T,NB является первой производной термодинамического потенциала по концентрации. Соответственно на графике зависимости G=f(C) представляет скорость ее изменения либо наклон к кривой в каждой ее точке.
Как известно из аналитической геометрии, уравнение касательной к кривой G(С), проведенной в точке G0(С0), имеет следующий вид:
G = G0(С0) + (∂G/∂СА)X0(СА - С0) (1.54)
Найдя точки пересечения ее с ординатами компонентов, т. е. подставив СА = 0 и СА = 1, можно убедиться, что полученные выражения в точности соответствуют парциальным энергиям Гиббса соответствующих компонентов в фазе состава, описываемого точкой, в которой проведена касательная. (Точки пересечения касательной к зависимости энергии Гиббса фазы с осями ординат, отвечающим чистым компонентам, соответствуют химическим потенциалам этих компонентов в данной фазе.)
Отсюда легко получается и условие равновесия фаз. Равенство химических потенциалов µАL = µАS и µВL = µВS означает, что касательные к кривым G(С) обеих фаз пересекают ординаты обоих компонентов в одних и тех же точках; но прямые, имеющие две общие точки, совпадают. Следовательно, на геометрическом языке условие равновесия двух фаз означает, что к кривым GL(С) и GS(С) можно провести общую касательную, причем составы твердой и жидкой фаз, находящихся в равновесии друг с другом, определяются точками касания общей касательной к обеим кривым свободной энергии.
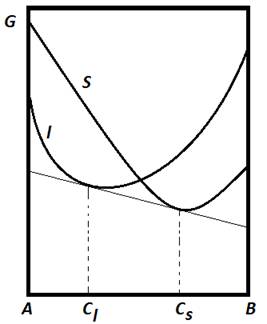
Условие равновесия двух фаз - общая касательная
|
из
5.00
|
Обсуждение в статье: ЗАВИСИМОСТЬ ЭНЕРГИИ ГИББСА ФАЗЫ ОТ СОСТаВА |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

