 |
Главная |
Неинерциальные системы отсчета. Силы инерции.
|
из
5.00
|
Неинерциальная система отсчета - система отсчета, в которой не выполняется первый закон Ньютона. Неинерциальная система отсчета движется с ускорением относительно некоторой инерциальной системы отсчет.
В инерциальных системах отсчёта единственной причиной ускоренного движения материальной точки являются силы, действующие со стороны материальных тел. В неинерциальных системах причиной ускоренного движения являются и силы инерции, не связанные ни с каким взаимодействием.
Сила инерции — фиктивная сила, которую можно ввести в неинерциальной системе отсчёта так, чтобы законы механики в ней совпадали с законами инерциальных систем.
Элементы механики сплошных сред. Общие свойства газов и жидкостей. Кинематиче-ское описание течения идеальной жидкости. Уравнения неразрывности и Бернулли. Вяз-кая жидкость. Силы внутреннего трения. Формула Стокса.
МЕХАНИКА СПЛОШНЫХ СРЕД — раздел механики, изучающий движение и равновесие газов, жидкостей идеформируемых твердых тел. В механике сплошных сред вещество рассматривают как непрерывнуюсплошную среду, его молекулярным (атомным) строением пренебрегают
Общие свойства газов и жидкостей:
1)жидкие и газообразные вещества не обладают упругостью формы – они легко принимают форму того сосуда, в котором находятся.
2) газы и жидкости характеризуются как сплошные среды
Основной характеристикой кинематического движения является скорость, которая характеризуется величиной и направлением в данный момент времени. Для того чтобы описать движение жидкости рассматривают множество частиц жидкости, которые в различные моменты времени проходят через одну и ту же точку пространства. Если таких точек взять много и при этом зафиксировать время, то , в пространстве получится мгновенная картина распределения скоростей жидкости – поле скоростей. В каждой точке пространства будет указан вектор скорости той частицы жидкости, которая проходит через эту точку в рассматриваемый момент времени. Для графического представления поля скоростей используют линии тока - линии, в каждой точке которых касательная совпадает по направлению со скоростью частиц жидкости в данный момент времени. Часть жидкости, ограниченную линиями тока называют трубкой тока.
 уравнением неразрывности
уравнением неразрывности  Уравнение Бернулли
Уравнение Бернулли
Вязкость (внутреннее трение) - это свойство реальных жидкостей оказывать сопротивление перемещению одной части жидкости относительно другой.
При перемещении одних слоев реальной жидкости относительно других возникают силы внутреннего трения, направленные по касательной к поверхности слоев. Действие этих сил проявляется в том, что со стороны слоя, движущегося быстрее, на слой, движущийся медленнее, действует ускоряющая сила. Со стороны же слоя, движущегося медленнее, на слой, движущийся быстрее, действует тормозящая сила.
Формула Стокса: F = 6πηrV
F- сила внутреннего сопротивления, η – коэф. Вязкости, r – радиус тела, v–скорость тела в жидкости.
Термодинамический и статистический методы исследования систем многих частиц. Макроскопическое состояние физических систем. Макроскопические параметры как средние значения. Модель идеального газа. Законы идеального газа. Уравнение состояния идеального газа.
Два метода для изучения свойств макроскопических систем:
Статический метод основан на законах теории вероятности и математической статистики.
Термодинамический метод не учитывает микроскопическое строение веществ и изучение его свойств основывается на анализе условий и количественных соотношений при превращениях энергий в рассматриваемом системе.
МАКРОСКОПИ́ЧЕСКОЕ СОСТОЯ́НИЕ (макросостояние) системы, определяется значениями ее термодинамических параметров: давления p, температуры Т, удельного объема v, внутренней энергии U и т. п. Для определения макроскопического состояния однокомпонентной системы достаточно знать значения любых 2 независимых параметров.
Средняя кинетическая энергия молекул

Среднеквадратичная скорость молекул
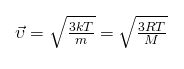
Модель идеального газа – газ, обладающий следующими свойствами:
1) Силы взаимодействия между молекулами отсутствуют
2) Молекулы рассматриваются как материальные точки
3) Соударения между молекулами подчиняются законам абсолютного упругого удара
Уравнение состояния идеального газа:

Законы идеального газа
1) Закон Бойля-Мариотта :при неизменных температуре и массе произведение численных значений давления и объема газа постоянно:
pV = const
2) Закон Шарля: При постоянном объеме и неизменных значения значениях массы газа и его молярной массы отношение давление газа к его абсолютной температуре остается постоянной.
p/T=const
3) Закон Гей – Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы отношение объема газа к его абсолютной температуре остается постоянным. V/T=const
4) Объединенный газовый закон :pV/T=constили
Закон Авогадро: при одинаковых давлениях и одинаковых температурах и равных объемах различных идеальных газов содержится одинаковое число молекул
11. Идеальный газ - это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало. - вводится для математического описания поведения газов. Реальные разреженные газы ведут себя как идеальный газ!
Свойства идеального газа: 1)взаимодействие между молекулами пренебрежительно мало 2)расстояние между молекулами много больше размеров молекул 3)молекулы - это упругие шары 4)отталкивание молекул возможно только при соударении 5) движение молекул - по законам Ньютона 6)давление газа на стенки сосуда - за счет ударов молекул газа.
Основное уравнение МКТ связывает микропараметры частиц ( массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р - давление, V - объем, Т - температура). Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Основное уравнение МКТ: 

Температура— мера средней кинетической энергии молекул.
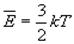 Средняя кинетическая энергия поступательного движения молекулыне зависит от её природы и пропорциональна абсолютной температуре газаT. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.Сравнивая уравнение состояния идеального газа и основное уравнение кинетической теории газов, записанные для одного моля (для этого число молекул N возьмём равным числу Авогадро NА), найдём среднюю кинетическую энергию одной молекулы:
Средняя кинетическая энергия поступательного движения молекулыне зависит от её природы и пропорциональна абсолютной температуре газаT. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.Сравнивая уравнение состояния идеального газа и основное уравнение кинетической теории газов, записанные для одного моля (для этого число молекул N возьмём равным числу Авогадро NА), найдём среднюю кинетическую энергию одной молекулы:
 и
и  .Откуда
.Откуда  .
.
12.
 График функции показан на рис. При v®¥
График функции показан на рис. При v®¥  асимптотически стремится к нулю. При
асимптотически стремится к нулю. При  (называемой наиболее вероятной скоростью)
(называемой наиболее вероятной скоростью)  достигает максимума. Площадь, ограниченная графиком
достигает максимума. Площадь, ограниченная графиком  и осью скоростей
и осью скоростей  , равна :
, равна :

 Опыт Штерна
Опыт Штерна
 Вдоль оси внутреннего цилиндра со щелью натянута платиновая проволока, покрытая слоем серебра, которая нагревается током при откачанном воздухе. При нагревании серебро испаряется. Атомы серебра, вылетая через щель, попадают на внутреннюю поверхность второго цилиндра, давая изображение щели. Если прибор привести во вращение вокруг общей оси цилиндров, то атомы серебра осядут не против щели, а сместятся на некоторое расстояние. Изображение щели получается размытым. Исследуя толщину осажденного слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
Вдоль оси внутреннего цилиндра со щелью натянута платиновая проволока, покрытая слоем серебра, которая нагревается током при откачанном воздухе. При нагревании серебро испаряется. Атомы серебра, вылетая через щель, попадают на внутреннюю поверхность второго цилиндра, давая изображение щели. Если прибор привести во вращение вокруг общей оси цилиндров, то атомы серебра осядут не против щели, а сместятся на некоторое расстояние. Изображение щели получается размытым. Исследуя толщину осажденного слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
13.При рассмотрении закона распределения Максвелла предполагалось, что молекулы равномерно распределяются по всему объему сосуда, что справедливо, если объем сосуда небольшой.
Для больших объемов равномерность распределения молекул по объему нарушается из-за действия силы тяжести, вследствие чего плотность, а следовательно, и число молекул в единице объема будут неодинаковым.
Рассмотрим молекулы газа, находящегося в поле тяготения Земли.
Допустим, на поверхности Земли (h = 0) давление атмосферы P0. На высоте h оно равно P. При увеличении высоты на dh давление уменьшится на dP:
dP = - ρgdh[ρ — плотность воздуха на данной высоте, ρ = mn0, где m — масса молекулы, n0 — концентрация молекул].
 P = n0kТ, получаемтогда
P = n0kТ, получаемтогда

Полагая, что на некоторой высоте h Т = соnst, g = соnst, разделяя переменные, интегрируем выражение à
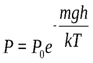
Получаемßбарометрическая формула.
Барометрическая формула показывает зависимость давления газа от высоты над поверхностью Земли.
Из формулы следует, что с понижением температуры число частиц на высоте, отличной от нуля, убывает и при Т = К обращается в нуль, т. е. при 0Квсе молекулы расположились бы на земной поверхности.
Так как потенциальная энергия молекул на различной высоте различна и на высоте h определяется по формуле где ЕП = mgh, то [см.

— закон Больцмана, показывающий распределение участвующих в тепловом движении молекул в потенциальном поле сил, в частности в поле силы тяжести.
14.В термодинамически неравновесных системах возникают особые - необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос :массы, энергии, импульса.
 1) Теплопроводность– перенос Энергии.В области газа средняя кинетическая энергия молекул больше,чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивание температур.
1) Теплопроводность– перенос Энергии.В области газа средняя кинетическая энергия молекул больше,чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивание температур.
Перенос энергии в форме теплоты подчиняетсязакону Фурье: jE—плотность теплового потока
·  –градиент температуры в направлении x, перпендикулярном выбранной площадке S,
–градиент температуры в направлении x, перпендикулярном выбранной площадке S,
·  –коэффициент теплопроводности.
–коэффициент теплопроводности.
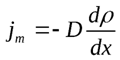 2)Диффузия- перенос Массы. Явление диффузии происходит самопроизвольное взаимопроникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел. Диффузия сводится к переносу массы, продолжается до тех пор, пока на границе соприкосновения двух сред градиент плотности отличен от нуля.
2)Диффузия- перенос Массы. Явление диффузии происходит самопроизвольное взаимопроникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел. Диффузия сводится к переносу массы, продолжается до тех пор, пока на границе соприкосновения двух сред градиент плотности отличен от нуля.
Количественно явление диффузии подчиняется закону Фика:  –плотность потока массы
–плотность потока массы
·  –градиент плотности газа в направлении x, перпендикулярном выбранной площадке S,
–градиент плотности газа в направлении x, перпендикулярном выбранной площадке S,
· D – коэффициент диффузии.
 Знак минус в приведенной формуле означает, что перенос массы происходит в направлении убывания плотности. Где D =
Знак минус в приведенной формуле означает, что перенос массы происходит в направлении убывания плотности. Где D =
·  – средняя скорость теплового движения молекул,
– средняя скорость теплового движения молекул,
·  –средняя длина свободного пробега молекул.
–средняя длина свободного пробега молекул.
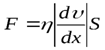 3) Внутреннее трение(вязкость) - перенос Импульса. Механизм внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя (движущегося быстрее) à уменьшается, ( движущегося медленнее) à увеличивается, что приводит к торможению слоя(движущегося быстрее) и ускорению слоя (движущегося медленнее) .
3) Внутреннее трение(вязкость) - перенос Импульса. Механизм внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя (движущегося быстрее) à уменьшается, ( движущегося медленнее) à увеличивается, что приводит к торможению слоя(движущегося быстрее) и ускорению слоя (движущегося медленнее) .
Внутреннее трение позакону Ньютона:h –коэффициент динамической вязкости
·  –градиент скорости, показывающий быстроту изменения скорости течения жидкости или газа от слоя к слою в направлении х,перпендикулярном направлению движения слоев,
–градиент скорости, показывающий быстроту изменения скорости течения жидкости или газа от слоя к слою в направлении х,перпендикулярном направлению движения слоев,
· S – площадь соприкосновения слоев(жидкости, газа) на которые действует сила внутреннего Fтрения.
15.Основные законы, которые являются основой термодинамики, называют началами. В основании термодинамики лежат три начала. Первое начало термодинамики является законом сохранения энергии для термодинамических процессов. В интегральном виде формула первого начала термодинамики выглядит как:  ,что означает: количество теплоты, подводимое к термодинамической системе, идет на совершение данной системой работы и изменение ее внутренней энергии. Условлено считать, что если теплота к системе подводится, то она больше нуля (
,что означает: количество теплоты, подводимое к термодинамической системе, идет на совершение данной системой работы и изменение ее внутренней энергии. Условлено считать, что если теплота к системе подводится, то она больше нуля (  ) и если работу выполняет сама термодинамическая система, то она положительна (
) и если работу выполняет сама термодинамическая система, то она положительна (  ).
).
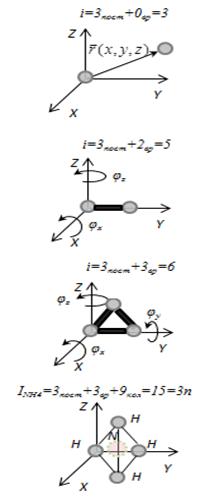
Число степеней свободы: механической системы называется количество независимых величин, е помощью которых может быть задано положение системы. Одноатомный газ имеет три поступательные степени свободы і = 3, так как для описания положения такого газа в пространстве достаточно трёх координат (х, у, z).
Жесткой связью называется связь, при которой расстояние между атомами не изменяется. Двухатомные молекулы с жесткой связью (N2, O2, Н2) имеют 3 поступательные степени свободы и 2 вращательные степени свободы: i=iпост +iвр=3 + 2=5.
Поступательные степени свободы связаны с движением молекулы как целого в пространстве, вращательные - с поворотом молекулы как целого. Вращение относительного осей координат x и z на угол  приведет к изменению положения молекул в пространстве, при вращении относительно оси у молекула не изменяет своё положение, следовательно, координата φy в данном случае не нужна. Трехатомная молекула с жёсткой связью обладает 6 степенями свободы
приведет к изменению положения молекул в пространстве, при вращении относительно оси у молекула не изменяет своё положение, следовательно, координата φy в данном случае не нужна. Трехатомная молекула с жёсткой связью обладает 6 степенями свободы
i=iпост +iвр=3 + 3=6
Если связь между атомами не жесткая, то добавляются колебательные степени свободы. Для нелинейной молекулы ікол. = 3N - 6, где N - число атомов в молекуле.
|
из
5.00
|
Обсуждение в статье: Неинерциальные системы отсчета. Силы инерции. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

