 |
Главная |
Спектр атома водородапо теории Бора
|
из
5.00
|
Пусть электрон вращается вокруг ядра по одной из разрешенных правилом квантования
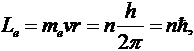
круговой стационарной орбите.
Решая совместно это уравнение с уравнение движения электрона

найдем радиусы стационарных («неизлучающих») орбит:

гдеn= 1, 2, 3…
Самой близкой к ядру орбите соответствует значение n = 1 (боровский радиус):

Полная энергия электрона в атоме водорода будет складываться из его кинетической энергии  и потенциальной энергии взаимодействия в электростатическом поле ядра
и потенциальной энергии взаимодействия в электростатическом поле ядра  :
:

Подставив в эту формулу радиусы орбит для стационарных состояний, получим, что энергия электрона может принимать только дискретные (квантованные) значения:

Подстановка значений физических постоянных в эту формулу позволяет определить минимальную энергию (n = 1) атома водорода –13,6 эВ. Это состояние называется основное состояние.
Состояния сn>1 называются возбужденными.
Энергия ионизации  – энергия необходимая для отрыва электрона, находящегося в основном состоянии, от атома. Для атома водорода
– энергия необходимая для отрыва электрона, находящегося в основном состоянии, от атома. Для атома водорода 
Согласно второму постулату Бора при переходе электрона с одной стационарной орбиты с энергией  на другую стационарную орбиту с энергией
на другую стационарную орбиту с энергией  <
<  атом испускает квант света с частотой
атом испускает квант света с частотой

Эта формула в точности совпадает с эмпирической (полученной опытным путем) формулой Ридберга для спектральных серий атома водорода,  если положить что
если положить что

Подстановка значений физических постоянных в эту формулу позволяла определить теоретическое значение постоянной Ридберга, которое очень хорошо совпала с экспериментальным значением.
Корпускулярно-волновой дуализм свойств веществ. Гипотеза де Бройля. Дифракция электронов и нейтронов. Волновые свойства микрочастиц и соотношения неопределённостей. Квантовые состояния. Волновая функция и её статистический смысл.
В 1924 г. французский физик Луи де Бройль выдвинул гипотезу о том, что дуализм не является особенностью только оптических явлений, а имеет универсальный характер: не только фотоны, но и электроны и любые другие микрочастицы материи обладают волновыми свойствами.
Согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, кор-пускулярные характеристики – энергия Е и импульс р, а с другой – волновые характе-ристики – частота и длина волны .

В 1961 г. К. Йенсен провел опыты по дифракции электронов на двух щелях – прямой аналог опыта Юнга для видимого света.
В результате попадания большого числа электронов на фотопластинке наблюдалась типичная интерференционная картина в виде чередующихся максимумов и минимумов, полностью аналогичная интерференционной картине для видимого света.
Позднее была обнаружена дифракция протонов, нейтронов и атомов водорода. Так было экспериментально доказано наличие у всех микрочастиц волновых свойств.
Подтвержденная экспериментально гипотеза де Бройля о корпускулярно-волновом дуализме свойств вещества коренным образом изменила представления о свойствах микрообъектов.Характер дифракционной картины свидетельствует о том, что на движение каждого электрона оказывают влияние оба отверстия. Такой вывод не совместим с представлением о траекториях, т. к. в прохождении каждого электрона участвуют оба отверстия – и первое, и второе. И так, основное отличие микрочастицы от привычной для нас макрочастицы заключается в том, что она не обладает одновременно определенными значениями координаты и импульса, вследствие чего применительно к микрочастице понятие траектории утрачивает смысл. («Длина волны в данной точке»! – абсурд!)
Следствия из соотношений неопределенностей:
• если микрочастица находится в состоя-нии с точным значением координаты, проекция ее импульса оказыва-ется совершенно неопределенной и наоборот;
• чем больше масса частицы, тем меньше неопределенности ее координаты и скорости;
•для энергии и времени соотношение неопределенностей примет вид: 
гдеЕ– неопределенность энергии микро-частицы в момент ее измерения,
t– неопределенность длительности про-цесса измерения;
•частота излучения фотона также долж-на имеет неопределенность ,  ,
,
т. е. спектральные линии должны ха-рактеризоваться частотой 
• измеряя ширину спектральной линии можно оценить порядок времени суще-ствования атома в возбужденном состо-янии.
Волновая функция должна быть:
•конечной (вероятность не может быть больше единицы);
•однозначной (вероятность не может быть неоднозначной величиной);
•непрерывной (вероятность не может изменяться скачком).
Кроме того, она должна иметь непрерыв-ные и конечные производные.
|
из
5.00
|
Обсуждение в статье: Спектр атома водородапо теории Бора |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

