 |
Главная |
Аналитические группы катионов по сероводородному методу
|
из
5.00
|
| Первая группа | Вторая группа | Третья группа | Четвёртая группа | Пятая группа |
| Li+, Na+, K+, Rb+, Cs+, NH4+. Группового реагента нет | Ca2+, Sr2+, Ba2-, Mg2+. Групповой реагент (NH4)2CO3 (слабощелочная среда) | Fe2+, Zn2+, Mn2+, Co2+, Ni2+, Al3+, Cr3+, Fe3+ и др. Групповой реагент (NH4)2S, pH=9 (слабощелочная среда) | Cu2+, Bi3+, Hg2+, Cd2+, AsIII, AsV, SbIII, SbV, SnII, SnIV и др. Групповой реагент H2S (кислая среда) | Ag+, Hg22+, Pb2+ Групповой реагент HCl (2н) |
4 3 2 1
 порядок осаждения катионов
порядок осаждения катионов
После отделения осадка AgCl, Hg2Cl2, РbС12 через оставшийся раствор пропускают газообразный сероводород. Так как в растворе НС1 (среда кислая), то при этом выпадают в осадок только сульфиды, нерастворимые в кислотах (катионы четвёртой группы). Равновесие
H2S ⇄ 2Н+ + S2-
в этом случае сильно смещено в сторону молекул H2S, а анионов S2- в растворе очень мало. Поэтому в осадок выпадут только сульфиды, ПР которых меньше 10-25, т. е. сульфиды четвертой аналитической группы.
Для осаждения катионов третьей группы кислый раствор (от НСl), оставшийся после отделения от него указанных сульфидов, нейтрализуют аммиаком (NH3(г)) до рН=9 и добавляют к нему раствор (NH4)2S. При этом в осадок выпадают сульфиды Fe2+, Zn2+, Со2+, Mn2+, Ni2+ и гидроксиды Сг3+, А13+, Fe3+, ПР которых >10-22. Далее при рН=9 к раствору добавляют (NH4)2СО3. При этом выпадают в осадок средние карбонаты катионов второй группы. В растворе остаются катионы первой группы.
В анализе анионов также используются групповые реагенты, действие которых основано на образовании малорастворимых соединений.
1) Анионы первой аналитической группы:
SO42-, SO 32-, CO 32-, РО43-, S2O32-, F-, SiO32-, BO2- и др..
Групповой реагент ВаС12 при рН=7-9.
2) Анионы второй аналитической группы:
Cl-, Br-, I-, S2-, CNS-, CN-, BrO3-, IO3-, ClO и др..
Групповой реагент AgN03 в кислой среде раствора НNО3.
3) К третьей аналитической группе относятся анионы, не осаждаемые катионами бария и серебра (не имеющие группового реагента):
NO3-, NO2-, C2H3O2-, ClO3-, MnO4- и др..
К методам количественного анализа относится объёмный (титриметрический ) анализ. Этот анализ используется в случае растворов и основан на измерении количества реагента, затраченного на реакцию с определяемым веществом. Уравнение химической реакции можно представить в общем виде:
X + R = XR ,
где Х – анализируемый раствор, содержащий неизвестное количество определяемого вещества Х (его эквивалентную концентрацию сэ(Х) следует определить); R – раствор реагента R с известной эквивалентной концентрацией сэ(R); XR – продукт реакции. В реакции (38) объем анализируемого раствора берут в виде определенной величины V(X) и добавляют к нему раствор реагента сколь угодно малыми порциями (каплями), фиксируя конец реакции по точке эквивалентности. Этот процесс получил название титрования (отсюда название «титриметрический анализ»). В точке эквивалентности вычисляют объем раствора реагента, затраченного на реакцию V(R).
Если реакция прошла до конца, то к ней можно применить закон эквивалентов:
cэ (R)V (R) = cэ (X)V (X)
или nэ (R) = nэ (X),
где nэ – числа молей эквивалентов. Так как в данную формулу входят объемы исследуемого раствора и раствора реагента, то отсюда название «объёмный анализ». В момент изменения окраски раствора (точка эквивалентности) прибавление по каплям раствора реагента прекращают и фиксируют объем оставшегося раствора реагента в бюретке V2. По разности V1 иV2 находят объем раствора реагента, затраченного на титрование:
V(R)= V1 - V2.
Точную концентрацию этого раствора (эквивалентную) устанавливают заранее до выполнения анализа. Следовательно, по результатам титрования можно вычислить число молей эквивалентов реагента, которое пошло на реакцию:
сэ (R)V (R) = n э (R).
По закону эквивалентов можно определить число молей определяемого вещества в растворе V(X):
cэ ( R )V ( R ) = n э ( X ).
Зная число молей эквивалентов определяемого вещества и его эквивалентную массу –М э (Х), можно вычислить его нормальную или молярную концентрацию:
сэ (Х) = сэ(R)V(R)/V(X),
с(Х) = сэ (Х)·Мэ (Х)/М (Х).
Весовой (гравиметрический) анализ основан на измерении массы определяемого компонента, выделенного из анализируемой пробы в свободном состоянии или в составе известного соединения. Несмотря на трудоёмкость, это основной метод аналитической химии, он самый надёжный. Известны три варианта весового анализа:
1. Метод выделения.
2. Метод осаждения.
3. Метод отгонки.
Во всех методах взвешивают исходную пробу.
Метод осаждения
В нем к осадкам предъявляют следующие требования:
1. Осадок должен быть практически нерастворимым. Значение его ПР не должно превышать 10-8Осадок должен иметь постоянную химическую формулу. Так, фосфаты и бораты двухвалентных металлов (соли кислот H3BO3, H3PO4) образуют осадки переменного состава, например:
MeHPO4; Me (H2PO4)2; Me3 (PO4)2.
Такие осадки не могут быть использованы в весовом анализе.
2. Осадок должен иметь форму, удобную для отделения его от раствора. Например, размер его частиц должен быть больше размера пор фильтра.
Аналитические весы являются в количественном анализе основным измерительным прибором. Поэтому надо знать приемы точного взвешивания. Используемые в аналитической химии аналитические весы ВЛА – 200 (весы лабораторные аналитические до 200г) и ВЛА – 20 (весы лабораторные аналитические до 20г) позволяют взвешивать навески (пробы) с точностью до ±2·10-4 г. Для точного взвешивания следует:
- учитывать по паспорту на гири их погрешность;
- учитывать силы Архимеда;
- учитывать по таблицам зависимость плотности воздуха от температуры, влажности и давления.
4. Разноплечность.
Физико-химические методы анализа. Число физических и физико-химических методов анализа составляет несколько десятков. Они были разработаны в связи с тем, что химические методы имеют ряд недостатков.
1) Во-первых, химическими методами можно определить компонент в растворе, если его в нем больше, чем 10-2 %:
10-2 % - хим. метод
10-5 -10-10 % - инструм. метод.
2) Второй причиной развития инструментальных методов является их экспрессность, т.е. высокая скорость получения результатов.
3) Инструментальные методы могут быть дистанционными, т.е. проводиться на расстоянии от анализируемого объекта или от оператора.
4) Инструментальные методы позволяют автоматизировать весь процесс анализа или отдельные его стадии.
Физические и физико-химические методы анализа имеют погрешность 2-5 %. В отличие от них погрешность химических методов анализа составляет всего 0,1-0,01 %.
Абсорбционные методы анализа основаны на ослаблении электромагнитного излучения при его прохождении через поглощающую среду.
Основной закон светопоглощения Бугера-Ламберта-Бера связывает уменьшение интенсивности света при прохождении через слой светопоглощающего вещества (например, раствора) с его концентрацией (с) и толщиной слоя (l):
I=Io·10-εlc,
где I и Io – соответственно интенсивность света, прошедшего через раствор и растворитель; ε - молярный коэффициент поглощения.
Уменьшение интенсивности света, прошедшего через раствор, характеризуют коэффициентом пропускания Т, который называют также пропусканием:
Т=I/Io.
Десятичный логарифм Т, взятый с обратным знаком, называется оптической плотностью А:
А=-lgT=-lg(I/Io)=lg(Io/I).
Учитывая (54), уравнение (52) можно представить в следующем виде:
А=εlс.
Из этого уравнения становится ясным физический смысл молярного коэффициента поглощения ε. А именно, он равен оптической плотности слоя раствора толщиной l = 1см при концентрации с = 1моль/л (тогда ε = А).
Закон Бугера-Ламберта-Бера справедлив для монохроматического света:
Аλ = ελlc.
Расчеты справедливы в области малых значений с. В-третьих, пучок света должен быть параллельным, а интенсивность рассеянного света должна быть сведена до минимума.
Приборы для измерения оптической плотности называются спектро- фотометрами. На рис. 1 представлена блок-схема спектрофотометра. По схеме видно, что луч белого цвета из источника излучения, пройдя через щель, попадает в монохроматор или светофильтр. После монохроматора луч света разделяется при помощи системы зеркал на два когерентных луча. Один из них проходит через анализируемое вещество, а другой служит для сравнения. Затем оба луча попадают в детектор, представляющий собой либо термоэлементы, либо фотоэлементы, при помощи которых измеряется разность энергий световых потоков – прошедшего через пробу и потока сравнения. Далее указанная разность энергий световых потоков при помощи усилителя преобразуется в выходной сигнал регистрирующего устройства. Результаты измерений обычно выражают либо в виде значений оптической плотности, либо в виде процентов пропускания (100% T).

Рис. 1. Блок-схема спектрофотомера (упрощенная)
В эмиссионных методах анализируемое вещество, находящееся обычно в газовой фазе, возбуждают и изучают спектр излучения его возбужденных частиц. Все эмиссионые спектры делятся на три группы: непрерывные спектры, излучаемые раскаленными твердыми телами и не содержащие отдельных линий; полосатые спектры, излучаемые возбужденными молекулами и содержащие группы линий; линейчатые спектры, излучаемые возбужденными атомами и содержащие отдельные линии. Линейчатые спектры атомов наиболее часто используются в эмиссионном спектральном анализе. Как правило, они имеют большое число линий – тысячи в спектрах атомов некоторых элементов, например, тория и урана. Но из всех линий, для того чтобы определить какой-либо элемент, используются так называемые аналитические или последние линии, т.е. линии, имеющие наибольшую интенсивность по сравнению с другими линиями того же элемента. При уменьшении в пробе содержания этого элемента аналитические линии в спектре исчезают в последнюю очередь. При какой-то очень малой концентрации остается всего несколько линий данного элемента. Эти линии хорошо изучены, их длины волн и характеристики интенсивности можно найти в таблицах и атласах спектральных линий элементов.
Лекция №8.
Электрохимия.
План лекции:
1. Понятие электродного потенциала металла. Стандартные электродные потенциалы. Ряд напряжений металлов.
2. Гальванические элементы и их типы.
3. Электролиз. Законы Фарадея.
При контакте металла (Ме) с раствором, содержащим его катионы, на границе металл-раствор устанавливается динамическое равновесие:
Me + mH2O ⇆ Men+∙(H2O)m + ne. (1)
В результате указанного равновесия на границе металл-раствор образуется двойной электрический слой (показанный на рис. 3), с разностью потенциалов между металлом и прилегающим к нему тончайшим слоем раствора, которая называется равновесным электродным потенциалом. Аналогичное равновесие возникает на границе металл-раствор при погружении металлического электрода в воду. Для упрощения гидратационную воду в уравнение реакции не включают, и тогда оно записывается в следующем виде:
Ме ⇆ Меn+ + nе.
Если пластину металла помещают в раствор соли этого же металла, то такую систему условно обозначают так:
Me│Mеn+; Zn│Zn2+; Fe│Fe2+, (2)
где вертикальная черта показывает границу раздела фаз, на которой возникает двойной электрический слой, динамическое равновесие и электродный потенциал. Например:
окисл. окисл.
Zn  Zn2+ + 2e; (E´) или Fe
Zn2+ + 2e; (E´) или Fe  Fe2+ + 2e; (E´´). (3)
Fe2+ + 2e; (E´´). (3)
восст. восст.
Видно, что электродные равновесия, называемые также электродными реакциями, – это окислительно-восстановительные процессы, где E – соответствующий равновесный электродный потенциал. При этом Е´≠ Е´´.
Стандартные электродные потенциалы металлов принято оценивать в вольтах (В) по отношению к стандартному водородному электроду при температуре 298 К и концентрации или активности растворов катионов, равной 1 моль на литр. На рис. 1(1) показан нормальный или стандартный водородный электрод, который состоит из стеклянной емкости с раствором серной кислоты и платинового электрода, покрытого платиновой чернью.
Н2(г)  2Н
2Н  2H+ + 2e; (Е=0) . (4)
2H+ + 2e; (Е=0) . (4)
Водородный электрод представляют схемой:
(Pt), H2│H2SO4 или (Pt), H2│H+. (5)
На рис. 1 показана схема измерения стандартного потенциала электрода из цинка, помещенного в раствор соли цинка с концентрацией ионов Zn2+ 1 моль/л. Стандартные электродные потенциалы (как и другие стандартные величины) принято обозначать с верхним индексом «о» и считать их для процессов восстановления. Например, для цинкового электрода (Zn2+ + 2e  Zn) стандартный электродный потенциал равен – 0,76 В (что записывается следующим образом
Zn) стандартный электродный потенциал равен – 0,76 В (что записывается следующим образом 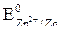 = -0,76 B). Аналогично схеме рис. 1 измеряют электродные потенциалы других металлов.
= -0,76 B). Аналогично схеме рис. 1 измеряют электродные потенциалы других металлов.
Зависимость величин электродных потенциалов от температуры и концентрации растворов выражается формулой Нернста:
 (6)
(6)
Так как величины R и F постоянные, то при постоянной Т = То, учитывая, что активность чистого вещества равна 1, вместо (6) получим:
 (7)
(7)
где коэффициент 0,059 учитывает указанные постоянные и перевод натурального логарифма в десятичный.
Уравнения равновесия электродной реакции и расчета потенциала водородного электрода будут следующими:
2Н+ + 2е ⇄ Н2,

где а(Н+) – активность ионов Н+ в растворе; р(Н2) – парциальное давление водорода.
Учитывая, что  а lgа(Н+)=-рН, получим:
а lgа(Н+)=-рН, получим:
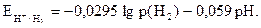 (8)
(8)
Видно, что потенциал водородного электрода зависит от рН раствора и парциального давления водорода.
Ряд напряжений
Положение металла в ряду напряжений характеризует его восстановительные свойства и окислительные способности его ионов. Чем меньше значение Е0, тем выше восстановительные свойства металла и тем ниже окислительные свойства его ионов. Так, например, Ba, Ca, Na являются хорошими восстановителями и легко окисляются до соответствующих ионов:
Ba – 2e = Ba2+; Ca – 2e = Ca2+; Na – 1e = Na+.
А ионы серебра, например, легко восстанавливаются:
Ag+ + e = Ag.
Каждый металл вытесняет из растворов солей те металлы, которые стоят правее его. Металлы с отрицательным значением электродного потенциала вытесняют водород из разбавленных растворов кислот.
|
из
5.00
|
Обсуждение в статье: Аналитические группы катионов по сероводородному методу |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

