 |
Главная |
Типы связей, участвующих в построении белковых молекул.
|
из
5.00
|
Холестерол жизненно необходим клеткам
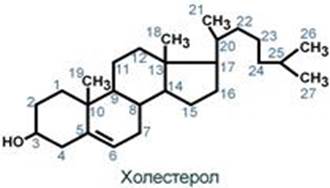
Холестерол относится к группе соединений, имеющих в своей основе циклопентан-пергидрофенантреновое кольцо, и яв. ненасы-ым спиртом.
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, при этом половина образуется в печени, около 15% в кишечнике, оставшаяся часть в любых клетках, не утративших ядро. Таким образом, все клетки организма способны синтезировать холестерол.Из пищевых продуктов наиболее богаты холестеролом (в пересчете на 100 г продукта) сметана (0,002 г), сливочное масло (0,03 г), яйца (0,18 г), говяжья печень (0,44 г). В целом за сутки с обычным рационом поступает около 0,4 г.
Выведение холестерола из организма происходит в основном через кишечник: -с фекалиями в виде холестерола, поступающего с желчью, и образованных микрофлорой нейтральных стеролов (до 0,5 г/сут), -в виде желчных кислот (до 0,5 г/сут), -около 0,1 г удаляется в составе слущивающегося эпителия кожи и кожного сала,-примерно 0,1 г превращается в стероидные гормоны (половые гормоны, глюкокортикоиды, минералокортикоиды) и после их деградации выводится с мочой.
Функции холестерола
1. Стру-ая – входит в состав мембран, повышая их вязкость и жесткость.
2. Связывание и транспорт полиненас-х жирных к-т между органами и тканями в составе липопротеинов низкой и высокой плотности. Примерно 1/4 часть всего холес-ла в ор-ме этерифицирована олеиновой к-той и полиненасыщенными ж-ми к-ами. В плазме крови соотн-ие эфиров холе-ла к своб-му холе-лу составляет 2:1.
3. Является предшественником желчных кислот, стероидных гормонов (кортизола, альдостерона, половых гормонов) и витамина D.
11. Желчные кислоты. Строение, свойства, биологическая роль.
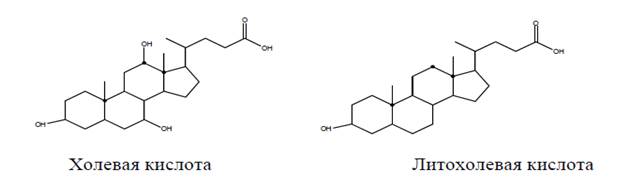
Из холестерина в печени образуются желчные кислоты. По химическому строению эти соединения близки к холестерину. Для них характерно наличие укороченной разветвленной боковой цепи с карбоксильной группой на конце. Двойная связь в кольце В отсу-ет, а кольца А и В сочленены в цис-положении. Стероидный кор в положениях 3, 7 и 12 содержит от одной до трех β-гидроксильных групп. Желчные кислоты обеспечивают растворимость холестерина в желчи и способствуют перевариванию липидов.
В печени вначале образуются первичные желчные кислоты − холевая и хенодезоксихолевая (антроподезоксихолевая). Дегидроксилирование этих соединений по С-7 микрофлорой кишечника приводит к образованию вторичных желчных кислот − литохолевой и дезоксихолевой.
В организме человека присутствуют шесть стероидных гормонов: прогестерон, кортизол, альдостерон, тестостерон, эстрадиол и кальцитриол За исключением кальцитриола, эти соединения имеют очень короткую боковую цепь из двух углеродных атомов или не имеют ее. Для большинства соединений этой группы характерно наличие оксогруппы при С-3 и сопряженной двойной связи С-4/С-5 в кольце А.
Различия наблюдаются в строении колец С и D. В эстрадиоле кольцо А ароматическое и, следовательно, гидрокси-я группа обладает св-ми фенольной ОН-группы. Кальцитриол отличается от гормонов позвоночных, однако также построен на основе холестерина. За счет светозависимой реакции раскрытия кольца В кальцитриол обр-т так называемый секостероид − стероид с раскрытым кольцом.
Экдизон − стероидный гормон насекомых − представляет собой более раннюю в эволюционном отношении форму стероидов. Стероидные гормоны, выполняющие сигнальную функцию, встречаются также в растениях.
12. Уровни структурной организации белков. Первичная, вторичная, свехвторичная структуры, домены, третичная и четвертичная структуры.
Белки(протеины)– это высокомолекулярные азотсодержащие соединения, состоящие из аминокислот, соединенных пептидной связью (-CО-NН-). Каждый белок характ-ется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией).
На долю белков приходится не менее 50% сухой массы орга-х соединений животной клетки. В орг-ме ч-ка насчитывается до 5 млн. разл-х видов белков.
Белковая молекула может содержать от пятидесяти до нескольких сотен (иногда более тысячи) аминокислотных остатков.
Молекулы, содержащие менее пятидесяти аминоки-х остатков, называют пептидами. В нативном состоянии белковые макромолекулы обладают специфической конформацией. Характерная для данного белка конформация опре-ся последовательностью аминок-ых остатков и стабилизируется водородными связями между пептидными и боковыми группами аминок-ых остатков, а также электростатич-ми и гидрофобными взаимодействиями.
Данилевский , высказал предположение о сущест-ии во всех белковых в-вах одина-х групп атомов и связей, аналогичных биурету NH 2 —СО— NH —СО— NH 2 . Э. Фишер (1902) сформулировал полипептидную теорию строения : белки представляют собой сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии α-карбоксильных СООН- и α-NН2-групп аминокислот.
Напр взаимо-ия аланина и глицина образование пептидной связи и дипептида:
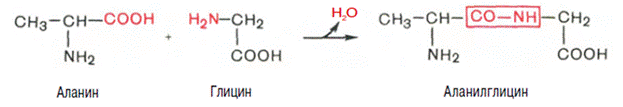
Под первичной структурой подразумевают порядок, последоват-сть расположения аминок-х остатков в полипептидной цепи. Зная местоположение каждого остатка аминок-ты, можно точно написать структурную формулу белковой молекулы, если она представлена одной полипептидной цепью.
Для опр-ия первичной стру-ры отдельной, хим-ки гомогенной полипептидной цепи, в первую очередь методами гидролиза выясняют аминок-й состав, точнее, соотн-ие каждой из 20 аминокислот в образце гомогенного полипептида. Затем приступают к опр-ию хим. природы концевых аминок-от полипептидной цепи, содержащей одну свободную NH2-группу и одну свободную СООН-группу.
Для определения природы N -концевой аминокислоты предложен ряд методов, в частности, метод Сэнжера. Этот метод основан на реакции арилирования полипептида 2,4-динитрофторбензолом. Раствор полипептида обрабатывают 2,4-динитрофторбензолом, который взаимодействует со свободной α-аминогруппой пептида. После кислотного гидролиза продукта реакции только одна аминокислота оказывается связанной с реактивом в виде 2,4-динитрофениламинок-ты. В отличие от других аминок-от она имеет желтый цвет. Ее выделяют из гидролизата и идентифицируют методом хроматографии.
Для определения С-концевой аминокислоты часто используют ферментативные методы. Обработка полипептида карбоксипептидазой, которая разрывает пептидную связь с того конца пептида, где содержится свободная СООН-группа, приводит к освобождению С-концевой аминокислоты, природа которой может быть идентифицирована методом хроматографии.
Следующий этап работы связан с определением последовательности аминокислот в полипептиде. Для этого вначале проводят частичный (химический и ферментативный) гидролиз полипептидной цепи на короткие пептидные фрагменты, последовательность которых может быть точно определена. После гидролиза с помощью электрофореза и хроматографии составляют пептидные карты. Затем устанавливают последовательность аминокислот в выделенных пептидах и первичную структуру всей молекулы.
Вторичная структура − это пространственное расположение полипептидной цепочки в виде α -спирали или β -складчатости безотносительно к типам боковых радикалов и их конформации.Л.К. Полинг и Р.Б. Кори предложили модель вторичной структуры белка в виде α-спирали, в которой водородные связи замыкаются между каждой первой и четвертой аминокислотой, что позволяет сохранять нативную структуру белка, осуществлять простейшие функции, защищать от разрушения.
В образовании водородных связей принимают участие все пептидные группы, что обеспечивает максимальную стабильность, снижает гидрофильность и увеличивает гидрофобность белковой молекулы. α-спираль образуется самопроизвольно и является наиболее устойчивой конформацией, отвечающей минимуму свободной энергии.
Наиболее распространенным элементом вторичной структуры является правая α -спираль ( αR ). Пептидная цепь здесь изгибается винтообразно. Ha каждый виток приходится 3,6 аминокислотного остатка, шаг винта, т.е. минимальное расстояние между двумя эквивалентными точками, составляет 0,54 нм;
Другая форма спирали присутствует в коллагене, важнейшем компоненте соединительных тканей. Это левая спираль коллагена с шагом 0,96 нм и при остатке в 3,3 в каждом витке более пологая по сравнению с α-спиралью. .
Наряду с α-спиралями в образовании вторичной структуры белка принимают также участие β -структуры, β -изгиб.
В отличие от конденсированной α-спирали β-слои почти полностью вытянуты и могут располагаться как параллельно, так и антипараллельно
Супервторичная структура − это более высокий уровень организации белковой молекулы, представленный ансамблем взаимодействующих между собой вторичных структур: 1. α -спираль − два антипараллельных участка, которые взаимодействуют гидрофобными комплементарными поверхностями (по принципу «впадина-выступ»); 2. сверхспирализация α -спирали;
3. β х β − два параллельных участка β -цепи; 4. β -зигзаг.
Под третичной структурой понимают пространственное расположение полипептидной цепи. В стабилизации пространственной структуры основную роль играют нековалентные связи. К ним относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот (гидрофобные взаимодействия), диполь-дипольные взаимодействия. И играют дисульфидные связи ( S - S -мостики).
Третичная структура – уникальное для каждого белка расположение в пространстве полипептидной цепи, зависящее от количества и чередования аминокислот, т.е. предопределенное первичной структурой белка.
Конфигурация белковых молекул может быть фибриллярной и глобулярной.
Третичная структура многих белков составляется из нескольких компактных глобул, называемых доменами. Между собой домены обычно бывают связаны тонкими перемычками вытянутыми аморфными полипептидными цепями.
Домен– компактная глобулярная структурная единица внутри полипептидной цепи. Домены могут выполнять разные функции и подвергаться свертыванию в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы.
При свертывании белковой глобулы значительная часть (не менее половины) гидрофобных радикалов аминокислотных остатков оказывается скрытой от контакта с окружающей белок водой.
Происходит образование своеобразных внутримолекулярных «гидрофобных ядер». В них особенно представлены объемные остатки лейцина, изолейцина, фенилаланина, валина.
Четвертичная структура − это надмолекулярное образование, состоящее из двух и более полипептидных цепей, связанных между собой нековалентно, а водородными связями, электростатическими, диполь-дипольными и гидрофобными взаимодействиями между остатками аминокислот, находящимися на поверхности.
Примером может служить молекула гемоглобина, вирус табачной мозаики (2130 субъединиц).
В образовании четвертичной структуры белка принимают участие те же связи, что и при образовании третичной структуры, за исключением ковалентных.
Объединение белковых молекул третичной структуры без появления новых биологических свойств называют агрегированным состоянием.
Как четверти-ая стр-ра, так и агрегированное состояние могут быть обратимо разрушены с применением детергентов, в частности, додецилсульфата натрия или неионных детергентов типа тритона. Очень часто для разрушения четвертичной структуры исследуемый белок нагревают при 100°С в присутствии 1%-ного 2-меркаптоэтанола и 2%-ного додецилсульфата натрия.
Характерной особенностью белков с четвертичной структурой является их способность к самосборке.
Взаимодействие протомеров осуществляется с высокой специфичностью, благодаря образованию десятка слабых связей между контактными поверхностями субъединиц, поэтому ошибки при формировании четвертичной структуры белков исключены.
Практически все белки-ферменты имеют четвертичную структуру и состоят, как правило, из четного числа протомеров (двух, четырех, шести, восьми). Четвертичная структура белка подразумевает такое объединение белков третичной структуры, при котором появляются новые биологические свойства, не характерные для белка в третичной структуре. В частности, такие эффекты, как кооперативный и аллостерический, характерны лишь для белков с четвертичной структурой.
Типы связей, участвующих в построении белковых молекул.
| Уровни организации белковой молекул | ||
| Структура белковой мо-лы | Харак-ка стр-ры | Тип связи, определябщий ст-ру |
| Первичная-линейная | Порядок чередования аминокислот в полипептидной цепи | |
| Вторичная-спиральная | Закручивание полипептидной линейной цепи в спираль | Внутримолекулярные водородные связи |
| Третичная-глобулярная | Упаковка вторичной спирали в клубокклубочковидная | Дисульфидные и ионные связи |
| Четвертичная | Соединение нескольких глобул в сложный комплекс | Все виды связей |
В молекуле белка различают прочные, ковалентные связи: пептидные, дисульфидные и непрочные, нековалентные связи: водородные, ионные, вандерваальсовые, гидрофобные.
Пептидные связи
Пептидные связи (-СО-NН-) яв. основным видом связей в белках. Впервые они были изучены А.Я. Данилевским (1888 г.). Пептидные связи образуются при взаимодействии α- карбоксильной группы одной аминокислоты и α - аминогруппой другой аминокислоты. Пептидная связь является сопряжённой связью, электронная плотность в ней смещена от азота к кислороду, в силу чего она занимает промежуточное положение между одинарной и двойной связью. Длина пептидной связи составляет 0,132 нм. Вращение атомов вокруг пептидной связи затруднено, атомы О и Н в ней находятся в транс-положении. Все атомы пептидной связи располагаются в одной плоскости. Атомы О и Н пептидной связи могут дополнительно образовывать водородные связи с другой пептидной связью. Пептидные связи определяют порядок чередования аминокислот в полипептидной цепи белка, т.е. формируют первичную структуру белка. Пептидные связи – прочные связи. Расщепление пептидных связей осущ-ется при кипячении белка в присутствии кислот, щелочей или под действием ферментов пептидаз.
Дисульфидные связи (-S- S-) образованы двумя молекулами цистеина в составе белковой молекулы. Возможны внутрицепочечные дисульфидные «мостики» в пределах одной полипептидной цепи и межцепочечные связи между отдельными полипептидными цепями. Напр, в молекуле гормона инсулина прис-ют оба варианта дисульфидных связей. Дисульфидные связи влияют на пространственную укладку белковой молекулы, т.е. на третичную структуру белков. Дисульфидные связи разрываются при действии некоторых восстановителей и при денатурации белка.
Водородные связи связивозникают между атомом водорода и электроотрицательным атомом (чаще кислородом). Водородные связи примерно в 10 раз слабее пептидных связей. Наиболее часто они возникают между атомом Н и атомом О различных пептидных связей: либо близко расположенных в молекуле белка, либо находящихся в разных полипептидных цепях. Большое количество водородных связей фиксирует в белках в основном вторичную структуру (α - спираль и β - складчатую структуру) а также участвует в образовании третичной и четвертичной структур белка. Непрочные водородные связи легко разрываются при денатурации белка.
Ионные связи образуются между противоположно заряженными аминокислотами в составе белковой молекулы (положительно заряженными лизином, аргинином, гистидином и отрицательно заряженными глютаматом и аспартатом). Ионные связи влияют на пространственную укладку белков, т.е. формируют третичную и четвертичную структуры белков. Ионные связи нарушаются при изменении рН среды, при денатурации.
Вандерваальсовые взаимодействия- разновидность связей, возникающих при кратковременной поляризации атомов.
Гидрофобные связи возникают между неполярными (гидрофобными) радикалами аминокислот в полярном растворителе (вода). Гидрофобные радикалы погружаются внутрь белковой молекулы, меняя пространственное расположение полипептидной цепи. Гидрофобные взаимодействия имеют энтропийную природу, придают устойчивость молекуле белка, участвуя в формировании его третичной, а также четвертичной структуры.
14. Физико-химические свойства белков: молекулярная масса, заряд белковых молекул, оптические свойства, растворимость, денатурация.
Белки(протеины) – это высокомолек-ые азотсодержащие соединения, состоящие из аминок-от, соединенных пептидной связью (-CО-NН-).
Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией).
На долю белков приходится не менее 50% сухой массы органических соединений животной клетки. В организме человека насчитывается до 5 млн. различных видов белков.
Белковая молекула может содержать от пятидесяти до нескольких сотен (иногда более тысячи) аминокислотных остатков.
Молекулы, содержащие менее пятидесяти аминокислотных остатков, называют пептидами. В нативном состоянии белковые макромолекулы обладают специфической конформацией. Характерная для данного белка конформация определяется последовательностью аминокислотных остатков и стабилизируется водородными связями между пептидными и боковыми группами аминокислотных остатков, а также электростатическими и гидрофобными взаимодействиями.
Главным свойством белков, обеспечивающим многогранность их биологических функций, называют способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ.
В частности, эта высокая специфичность белков (сродство) обесп-ет взаимо-ие ферм-в с субстратами, антител с антигенами, транспортных белков крови с переносимыми мол-лами других в-в и т.д.
Это взаимо-ие основано на принципе биоспецифического узнавания, завершающегося связыванием фермента с соответствующей мол-лой субстрата, что содействует протеканию химической реакции. Наиболее богаты белковыми веществами ткани и органы животных. Источником белка являются также микроорганизмы и растения. Большинство белков хорошо растворимо в воде.
В мышцах, легких, селезенке, почках на долю белков приходится более 70-80% от сухой массы, а во всем теле человека – 45% от сухой массы. В отличие от животных тканей в растениях содержится значительно меньше белков.
Для изучения химического состава, строения и свойств белков их обычно выделяют или из тканей, или из культивируемых клеток, или биологических жидкостей, в химически чистом, гомогенном состоянии.
Элементный состав белков, в пересчете на сухое вещество представлен 50-54% углерода, 21-23% кислорода, 6,5-7,3% водорода, 15-17% азота и до 0,5% серы.
В составе некоторых белков присутствуют в небольших количествах фосфор, железо, марганец, магний, йод и др.
В связи с тем, что в состав белков входи азот, их принято обозначать как азотсодержащие органические вещества. Содержание азота примерно одинаково во всех белках (около 16%).
Денатурация белков
Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства, т.е. денатурируют.
Денатурация нарушение уникальной структуры нативной молекулы белка, ее третичной структуры, приводящее к потере характерных свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.) (рис.).
Большинство белков денатурирует уже при нагревании их растворов выше 50–60°С.
При денатурации происходит потеря растворимости белка, повышение вязкости белковых растворов,
увеличение количества свободных функциональных SH-групп и
изменение характера рассеивания рентгеновских лучей.
Характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной).
При денатурации белка разрушаются
нековалентные связи (в частности, гидрофобные взаимодействия водородные связи).
Дисульфидные связи (в присутствии меркаптоэтанола) разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются.
Т.о. развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
Денатурация белков с потерей биологической активности может происходить под действием высокой температуры, ультрафиолетового излучения, кислот, щелочей, ионов тяжелых металлов.
Денатурация бывает обратимой (ренатурация) и необратимой.
15. Хромопротеины. Строение, свойства, биологическая роль.
Состоят из простого белка и связанного с ним окрашенного небелк-го комп-та.Различают гемопротеины (содержат в качестве простет-ой группы железо), магнийпорфирины и флавопротеины (содержат производные изоаллоаксазина).
функций:-Участвуют в процессах фотосинтеза;-Участвуют в процессах дыхания клеток и целостного организма;-Осуществляют транспорт кислорода и диоксида углерода;-Участвуют в окислительно-восстановительных реакциях;Обеспеч-ют свето- и цветовосприятие и др. К группе гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система каталаз и пероксидаза). Все они содержат в качестве небелкового комп-та структурно сходные железо- (или магний) порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций. Белки в роли переносчиков: глобины Гемоглобин – это белок, переносящий кислород от легких к тканям и осуществляющий транспорт углекислого газа от тканей обратно к легким. Гемоглобин локализован в красных кровяных тельцах – эритроцитах. состоит из четырех полипептидных цепей – двух идентичных α-цепей (обозначаемых α1 и α2) и двух идентичных β-цепей (обозначаемых β1 и β2). Каждая цепь связана с особой группой – гемом. Миоглобин – это белок, который содержится в мышечных клетках и участвует в запасании кислорода. В условиях когда рО2 в ткани падает, О2 высвобождается из комплекса с миоглобином и используется в митохондриях клеток.Он состоит из одной полипептидной цепи и имеет один гем. Третичная структура α - и β -цепей гемоглобина и цепи миоглобина оказалась сходной . Во всех трех полипептидах около трех четвертей остатков входит в состав α-спиралей. Все три цепи состоят из шести длинных α-спиральных сегментов, обозначаемых A, B, E, F, G и H, в каждом из которых находятся от 10 до 25 остатков. В области между спиралями B и E структура цепей различается.
В миоглобине имеются две дополнительные α-спирали, C и D, которые в цепях гемоглобина либо отсутствуют, либо деформированы.
Общая укладка α-спиралей во всех трех цепях настолько похожа, что принято говорить о «глобиновом типе сворачивания».
Гем сос-т из атомов C , N , Н, обра-их плоское кольцо, называемое порфи-рином. В центре этого кольца нах-ся атом железа, связанный с атомами кольца четырьмя из шести своих возможных координационных связей. К гему примыкают два остатка His. Ближайший гистидин связан с атомом железа через пятую координационную связь. Шестая координационная связь предназначена для присоединения кислорода или других лигандов: СО, цианидов и др.
Дальний гистидин располагается с противоположной стороны порфиринового кольца по отношению к ближнему гистидину и не образует связи с гемовым железом – здесь должно остаться достаточно свободного пространства для размещения кислорода. Дезоксигемоглобин – это гемоглобин, не связанный с кислородом. В дезоксигемоглобине атом железа находится вне плоскости порфиринового кольца и, кроме того, имеется несколько солевых мостиков и водородных связей, которых нет в оксигенированной форме белка. Некоторые из этих связей образуются между атомами одной и той же цепи, другие – между атомами, принадлежащими различным цепям. Оксигемоглобин – это гемоглобин, связанный с кислородом. Кислород присоединен по шестой координационной связи атома железа гема и располагается рядом с дальним остатком гистидина. При связывании кислорода атом железа перемещается в плоскость порфиринового кольца. Однов-но с этим происходят и некоторые другие конформационные изменения, в том числе сдвиг E и F-спиралей. Основная перестройка происходит в четвертичной структуре гемоглобина – α1 и β1 цепи поворачиваются как единое целое относительно α2 и β2 цепей. В результате в оксигемоглобине оказывается меньше солевых мостиков, чем в дезоксигемоглобине.
Связывание кислорода миоглобином и гемоглобином можно описать с помощью кривых связывания. Степень оксигенации гемогрупп зависит от концентрации присутствующего в среде кислорода (на графике концентрация кислорода выражена в виде его парциального давления). Для миоглобина график представляет собой гиперболу, что и следует ожидать при простом одноэтапном связывании. В случае гемоглобина график имеет S-образную форму: это говорит о наличии эффекта положительной кооперативности, т.е. о том, что после оксигенации одной или большего числа субъединиц сродство остальных субъединиц к кислороду возрастает.
S-образность кривой связывания кислорода гемоглобином объясняет, каким образом в тканях происходит освобождение О из этого белка. Умен-ие парциального давления О при переходе от артерий к венам при-водит к снижению степени оксигенации от почти 100% до примерно 75%. Кислород, диссоциировавший из комплекса с гемоглобином в венах, подхватывается миоглобином, имеющим к нему большее сродство. Кооперативные эффекты связыв-ия кислорода гемоглобином можно объяснить в рамках симметричной модели Моно, Уаймена и Шанжё. Гемоглобин может нах-ся в двух состояниях, различающихся взаимным расположением субъединиц и числом межсубъединичных контактов. Структура белка в одном из состояний соответствует структуре дезоксигемоглобина, а в другом — структуре оксигемоглобина. В первом состоянии белок обладает меньшим сродством к кислороду и имеет больше солевых мостиков и водородных связей, чем во втором. Согласно модели Моно, Уаймена и Шанжё, первое состояние гемоглобина — это Т-форма (tense-state), а второе — R-форма белка (relaxed-state).
Положение равновесия между T- и R-формами зависит от концентрации кислорода — чем она выше, тем в большей степени равновесие сдвинуто в сторону R-формы.
Связывание молекулы кислорода одной из цепей вызывает конформационные изменения в гемогруппе этой цепи и далее во всей субъединице. Эти изменения увеличивают вероятность перехода всей молекулы гемоглобина из Т- в R-состояние.
Связывание второй и третьей молекул кислорода еще больше увеличивает эту вероятность. Оказавшись в R-форме, гемоглобин еще легче связывает последнюю, четвертую молекулу кислорода. В результате гораздо более вероятно, что молекула гемоглобина не будет связывать ни одной или связывать четыре молекулы кислорода, чем какое-либо промежуточное их число.
Эффект Бора, заключающийся в высвобож-ии протонов при присое-ии О к гемоглобину, очень важен для транс-та углек-го газа из тканей к легким.
Дифосфоглицерат (ДФГ), обнаруживаемый в эритроцитах, участвует в регуляции процесса присоединения кислорода к гемоглобину. ДФГ легко образует комплекс с дезоксигемоглобином, связываясь в щели между двумя β-цепями, но обладает низким сродством к оксигемоглобину. Поэтому присутствие ДФГ в высоких концентрациях уменьшает сродство гемоглобина к кислороду и вызывает высвобождение кислорода в ткани.
Гемоглобин плода человека (фетальный гемоглобин) отличается от гемоглобина взрослых тем, что в нем две β-цепи заменены двумя γ-цепями. Гемоглобин плода связывает ДФГ менее сильно, чем дезоксигемоглобин взрослых, и поэтому имеет более высокое сродство к кислороду. В результате, когда кровь плода обогащается кислородом за счет материнской крови, что имеет место в плаценте, кислород переходит от матери к плоду с высокой эффективностью.
Влияние pH на сродство гемогло-на к кисл-ду носит назв-ие эффект Бора. При закислении среды сродство снижается, при защелачивании – повышается. При повышении концентрации протонов в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина. Реакция взаим-ия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов Н+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстанов-ый гемоглобин (Н-Нb) с низким сродством к кислороду. В легких поступающий кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
16. Фосфопротеины. Строение, свойства, биологическая роль.
К белкам этого класса относятся казеиноген молока, в к-м соде-ие фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, содержащийся в икре рыб, и др. Большое количество фосфопротеинов содержится в клетках ЦНС. Фосфопротеины занимают особое положение в биохимии фосфорсодержащих соед-ий не только в р-те своеобразия стру-ой организации, но и вследствие широкого диапазона функций в метаб-ме. Характерной особе-ью стр-ры фосфопротеинов является то, что фосфорная к-та ока-ется связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиамино-от, главным образом серина и в меньшей степени треонина. На одну мол-лу белка обычно приходится 2–4 остатка фосфата. Ионный тип связи между белками и фосфолипидами .
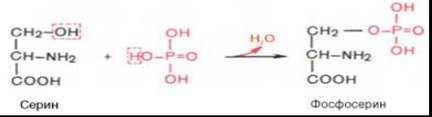
Фосфорная кислота может выполнять:-Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине молока, яичном альбумине. -Функциональную роль. В клетке присутствует много белков, которые связаны с фосфатом не постоянно, а в зависимости от активности метаболизма. Белок может многократно переходить в фосфорилированную или в дефосфорилированную форму, что играет регулирующую роль в его работе. Напр, 1) ферменты гликогенсинтаза и гликогенфосфорилаза (см "Регуляция акти-ти ферм-в"), 2) гистоны в фосфорилиров-ом состоянии менее прочно связываются с ДНК и активность генома возрастает. Фосфопротеины в головном мозге содержатся в большем количестве, чем в других органах и тканях,— около 2% от общего количества всех сложных белков мозга. Фосфопротеины обнаружены в мембранах разл-х морфологических структурнервной ткани.Фосфопротеины в качестве простетической группы содержат ортофосфор-ную кислоту связанную с гидроксилом серина или треонина. К фосфопро-теинам относятся многие питательные белки, например основной белок молока — казеин, к-й кроме фосфорной группы имеет также в своем составе углеводный компонент. Белок яичного желтка — вителлин, икры рыб — ихту-лин.
17. Гликопротеины и протеогликаны. Строение, свойства, биологическая роль.
Гликопротеиды получили название от слова «glucos» - сладкий, т. к. было установлено, что они содержат углеводы. Простетическая группа представлена различными углеводами и их производными, связь ее с белком ковалентная, углеводпептидная. к гликопротеидам относятся только те белки, у которых концентрация углеводов составляет более 4%. Все гликопротеиды обладают высокой молекулярной массой (до нескольких млн. Д), кислыми свойствами, растворимы в воде, слабых растворах нейтральных солей и щелочей, осаждаются кислотами и обладают высокой вязкостью. Они термостабильны, т. к. углеводы, входящие в их состав, значительно повышают устойчивость молекул к различным хим. веществам и нагреванию, защищают их от действия протеаз, определяя тем самым биологическую роль гликопротеидов. Углеводы придают белкам большую специфичность, за счет этих групп макромол-лы гликопротеида могут распознавать другие структуры.
Гликопротеиды в большом кол-ве содержатся в межклеточном в-ве соедин-ой ткани, плазме крови, слюне и других секретах, в составе цитоплазмат-х и разл-х внутриклет-х мембран, в цитозоле. Роль гликопротеидов разнообразна. Они транспортируют гидрофобные в-ва и ионы металлов; входя в состав рецепторов мембран, обесп-ют специфичность контактов клетки, влияют на дифференцировку тканей, участвуют в иммунолог-х реакциях, выполняют защитную роль, покрывая слизистые оболочки. Делятся на истинные гликопротеиды и протеогликаны. ( по % соотн-ии белковой части и простети-ой группы, и строении простетической группы). 1. Истинные гликопротеиды, строение, представители: муцины; иммуноглобулины; белки, обусловливающие группу крови; гормоны; транспортные белки; ферменты; рецепторы, их значение, распространение. В составе истинных гликопротеидов на белковую часть приходится около 80%, а на долю простетической группы – примерно 20%. В истинных гликопротеидах простетическая группа представлена полисахаридами, не имеющими регулярного строения. В состав простетической группы истинных гликопротеидов входят различные моносахариды и
|
из
5.00
|
Обсуждение в статье: Типы связей, участвующих в построении белковых молекул. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

