 |
Главная |
Реактивы и оборудование.
|
из
5.00
|
3.1. Аналитические весы, разновесы.
3.2. Посуда: мерные колбы на 100 и 250 мл, цилиндры, конические колбы, бюретки на 25 мл, пипетки на 10 и 20 мл, стаканы на 100 мл, воронки.
3.3. Реактивы: трилон Б, стандартный 0,1н раствор сульфата магния, раствор хлорида кальция, аммиачный буферный раствор, эриохром черный Т.
Основные сведения.
Метод комплексонометрии основан на реакции, в результате которой рабочий рас- твор с определяемым ионом образует прочное комплексное соединение.
В молекуле комплексного соединения один из ионов (обычно положительно заря- женный) занимает центральное место и называется комплексообразователем или цен- тральным атомом. Вокруг него в непосредственной близости координировано некоторое число противоположно заряженных ионов или нейтральных молекул, которые называются лигандами или адендами и образуют внутреннюю координационную сферу соединения. Внутренняя координационная сфера называется комплексным ионом. Остальные ионы, на- ходящиеся на более далеком расстоянии от центрального атома, составляют внешнюю ко- ординационную сферу и заряжены противоположно комплексному иону. Число лигандов, окружающих центральный атом, называется координационным числом.
Например,
K2[PtCl4]: Pt2+ – комплексообразователь
Cl– – лиганд
[PtCl4]2- – комплексный ион, внутренняя координационная сфера
K+ – внешняя координационная сфера
4 – координационное число
Таблица 1
Наиболее характерные координационные числа в растворах:
| Заряд центрального атома | +1 | +2 | +3 | +4 |
| координационное число (к.ч.) | 2 | 4 | 6 | 8 |
Координационное число не является неизменной величиной для данного комплексо- образователя, а обусловлено также природой лиганда, его электрическими свойствами. Для одних и тех же комплексообразователя и лигандов координационное число зависит от агре- гатного состояния, концентрации компонентов и температуры раствора.
При растворении ионы внешней сферы легко отщепляются, и комплексное соедине- ние практически нацело диссоциирует на внутреннюю и внешнюю сферы:
K2[PtCL4] Û 2K+ + [PtCl4]2-
|
1ст. [PtCl4
]2- Û [PtCl ]- + Cl-
k1 =
[[PtCl3

[[
PtCl 4
]- ]× [Cl- ]
]2- ]
2ст. [PtCl3
]- Û [PtCl ]0 + Cl-
k 2 =
[[PtCl 2

[[
2
]0 ]× [Cl- ]
]- ]
3ст. [PtCl2 ] Û [PtCl] + Cl
0 + -
k 3 =
PtCl 3
[[PtCl]+ ]× [Cl- ]

|
4ст. [PtCl]+ Û Pt 2+ + Cl-
Суммарный процесс диссоциации:
k 4 =
[Pt 2+ ]×[Cl- ]

[[PtCl]+ ]
[PtCl4
]2- Û Pt 2+ + 4Cl-
k сумм. = k1 × k 2 × k 3 × k 4 =
|
 |
= [[PtCl
]2- ]
Константу диссоциации комплексных соединений называют константой нестойко- сти (Кнест.).
По современным представлениям образование комплексного соединения происходит также ступенчато:
1ст.
Pt 2+ + Cl- Û [PtCl]+
[[PtCl]+ ]
 k1 = [Pt 2+ ]× [Cl- ]
k1 = [Pt 2+ ]× [Cl- ]
2ст. [PtCl]+ + Cl- Û [PtCl ]0

[[PtCl
]0 ]

|
|
|
3ст. [PtCl
]0 + Cl- Û [PtCl ]-

[[PtCl
]- ]
 k 3 = [[ ]0 ]3 [ ]
k 3 = [[ ]0 ]3 [ ]

4ст. [PtCl
]- + Cl- Û [PtCl
]2-
PtCl 2
[[PtCl
× Cl
|
 k 4 = [[ ]-4] [ ]
k 4 = [[ ]-4] [ ]

Суммарное равновесие:
PtCl3 × Cl
|
]2-
k сумм. = k1 × k 2 × k 3 × k 4 =
[[PtCl 4

|
|
]2- ]
- ]4
Каждая ступень характеризуется ступенчатыми константами, которые называются ступенчатыми константами устойчивости комплексного соединения. Константа равно- весия суммарного процесса называется суммарной константой устойчивости комплексного соединения (Куст.):
Ê уст. = Ê
1 .
 нест.
нест.
Широкое применение комплексонометрия получила с тех пор, как в практику анали- тической химии вошли аминополикарбоновые кислоты и их соли, получившие названия комплексонов. Комплексоны образуют малодиссоциирующие растворимые в воде ком- плексные соединения с катионами многих металлов независимо от их валентности. При этом реакции проходят в строго эквивалентных отношениях. Известно свыше 50 комплек- сонов.
Комплексонометрическое титрование позволяет значительно сократить время анализа и является очень простым и точным.
Наиболее широкое применение из комплексонов получила двунатриевая соль этилен- диаминтетрауксусной кислоты (ЭДТА), которую называют трилоном Б или комплексоном III:
 HOOCH2C
HOOCH2C
 NaOOCH2C
NaOOCH2C
N CH2
 CH2
CH2
CH2COONa


 N
N
CH2COOH
. 2H2O
 Комплексон III, как и другие комплексоны, образует растворимые внутрикомплекс- ные соли со многими металлами. При этом металл замещает атомы водорода карбоксиль- ных групп -COOH, а также связывается координационной связью с атомами азота:
Комплексон III, как и другие комплексоны, образует растворимые внутрикомплекс- ные соли со многими металлами. При этом металл замещает атомы водорода карбоксиль- ных групп -COOH, а также связывается координационной связью с атомами азота:


 -OOCH 2C
-OOCH 2C
 -OOCH 2C
-OOCH 2C
N H 2C H 2C N
CH2CO


 O
O

 Ca
Ca
 O CH2CO
O CH2CO
2-
 Na2+
Na2+
Если трилон Б сокращенно обозначить формулой
Na 2 H 2 Tr × 2H 2O , то образование
комплекса с ионами Ca2+ можно представить уравнением реакции:
Ca 2+ + Na
2H2
Tr Û Na 2
[CaTr]+ 2H+.
Чтобы сдвинуть равновесие в сторону образования комплекса, следует связать ионы водорода. Это достигается прибавлением аммиачного буфера (NH4OH + NH4Cl).
Точку эквивалентности устанавливают с помощью индикаторов: кислотного хрома темно-синего, мурексида, хромогена черного специального ЕТ-00 (эриохром черный Т) и др.
Эти индикаторы называются металлохромными, или металл-индикаторами. Они представляют собой органические красители, образующие с ионами металла окрашенные комплексные соединения, менее прочные, чем комплекс металла с комплексоном.
Эриохром черный Т представляет собой о,о’-диоксиазосоединение C20H13O7N3S,
OH OH


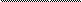 HO3S N N
HO3S N N
NO2
которое при pH=7-11, когда индикатор имеет синий цвет, образует с ионами кальция, маг- ния, цинка, кадмия, кобальта, никеля и ряда других металлов внутрикомплексные соедине- ния, окрашенные в вишнево-красный цвет:
Ca 2+ + HInd2- Û
синий
CaInd-
вишнево-красный
+ H+.
При титровании раствором трилона Б такого окрашенного комплекса он постепенно разрушается. При этом ионы металла переходят от индикатора к трилону Б, образуя с ним более прочное внутрикомплексное соединение. Освободившийся индикатор остается в рас- творе и окрашивает его в зеленовато-синий цвет. Вблизи точки эквивалентности, когда почти все определяемые ионы будут связаны в комплекс, происходит переход окраски рас- твора от вишнево-красной к синей:
CaInd- + [H Tr]2- Û [CaTr]2- + HInd 2- + H+.
иишнево-красный
2
бесцветный
бесцветный
синий
|
из
5.00
|
Обсуждение в статье: Реактивы и оборудование. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

