 |
Главная |
Примеры решения задач по теме « Гравиметрический анализ»
|
из
5.00
|
Пример 1. Вычислите факторы пересчета для следующих веществ:
Вещество Ca Cl S Cr Fe2O3 MgSO4
Гравиметрическая CaO AgCl BaSO4 Cr2O3 FePO4 Mg2P2O7
форма
Решение: Для каждого вещества используем формулу (3.20):
F1 = M (Ca) / M (CaO) = 40.08 / 56.08 = 0.7147
F2 = M (Cl) / M (AgCl) = 35.453 / 143.32 = 0.2474
F3 = M (S) / M (BaSO4) = 32.064 / 233.40 = 0.1374
F4 = 2 M (Cr) / M (Cr2O3) = (2×51.996) / 151.99 = 0.6842
F5 = M (Fe2O3) / 2 M (FePO4) = 159.69 / (2×150.82) = 0.5294
F6 = 2 M (MgSO4) / M (Mg2P2O7) = (2×120.37) / 222.57 = 1.0816
Пример 2. После соответствующей обработки 0.9000 г сульфата калия-алюминия получен осадок Al2O3 массой 0.0967 г. Вычислите массовую долю (%) алюминия в исследуемом образце.
Решение: Формула сульфата калия-алюминия KAl(SO4)2 ∙ 12 H2O.
Определяемый компонент - Al ; гравиметрическая форма - Al2O3 . В этом случае гравиметрический фактор с учетом стехиометрических коэффициентов рассчитываем по формуле
F = 2 M(Al) / M (Al 2O3) = (2×26.981) / 101.96 = 0.5292
Для вычисления содержания алюминия используем формулу (3.22):
ω (%) = F ∙ 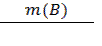 ∙100%
∙100%
w (Al), % = (0.5292 ∙ 0.0967 / 0.9000) ∙ 100% = 5.69%
Ответ: Массовая доля алюминия в исследуемом образце w (Al) = 5.69%.
Пример 3. Какую навеску сульфата железа FeSO4 ∙ 7 H2O следует взять для определения в нем железа в виде Fe2O3 , считая массу осадка (Fe2O3) равной 0.2000 г?
Решение: Определяемый компонент (вещество) - FeSO4 ∙ 7 H2O;
гравиметрическая форма - Fe2O3 . В данном случае фактор пересчета с учетом стехиометрических коэффициентов рассчитываем по формуле:
F = 2 М (FeSO4 ∙ 7 H2O) / M (Fe2O3) = (2×278.02)/159.69 = 3.4820.
Тогда навеску FeSO4 ∙ 7 H2O рассчитываем по формуле:
m (FeSO4 ∙ 7 H2O) = F ∙ m (Fe2O3) = 3.4820 ∙ 0.2000 = 0.6964 г.
Ответ: m (FeSO4 ∙ 7 H2O) = 0.6964 г.
Контрольные задания 191-200
(гравиметрический анализ)
191. а)Охарактеризуйте методы отгонки и осаждения.
б) В растворе, содержащем ионы хлора, хлор осажден в виде AgCl, масса которого после высушивания и прокаливания оказалась равной 0.1562 г. Написать уравнение реакции и вычислить массу хлора в растворе.
192. а) Что такое гравиметрический анализ? Его достоинства и недостатки. Для определения содержания каких веществ применяется?
б) Для определения сульфатной серы в минерале его навеску в 1.1850 г перевели в раствор, а сульфат - ионы осадили в виде BaSO4. Осадок промыли, высушили и прокалили. Масса BaSO4 составила 0.1321 г. Вычислить массу и массовую долю (%) серы в навеске.
193. а) Что представляют собой осаждаемая и гравиметрическая формы?
Рассмотрите на примере определения катионов магния. Напишите уравнения реакций и рассчитайте гравиметрический фактор.
б) Вычислите массовую долю (%) гигроскопической воды в хлориде натрия по следующим данным: масса бюкса 0.1282 г; масса бюкса с навеской 6.7698 г; масса бюкса с навеской после высушивания 6.7506 г.
194. а)Перечислите химическую посуду и приборы, необходимые для проведения метода осаждения в гравиметрическом анализе.
б)Из навески серебряного сплава 0.2466 г, после соответствующей обработки, был получен осадок хлорида серебра массой 0.2675 г. Вычислить массовую долю ( %) серебра в сплаве.
195. а)Перечислите правила взвешивания на аналитических весах.
б) В растворе хлорида магния осадили магний в виде MgNH4PO4. После прокаливания масса полученного осадка Mg2P2O7 была равна 0.1113 г. Написать уравнения реакций и вычислить массу магния в растворе.
196. а)Опишите операцию фильтрования осадков. Как правильно выбрать фильтр для того или иного случая фильтрования?
б) Вычислить навеску карбоната кальция, необходимую для получения осадка (гравиметрической формы) CaO массой 0.3000 г.
197. а) Как проводятся вычисления результатов анализа в методе осаждения?
б) В растворе сульфата железа (III) железо было осаждено в виде гидроксида. Масса прокаленного осадка Fe2O3 оказалось равной 0.3288 г. Вычислить массу железа в растворе.
198. а) Что представляют собой осаждаемая и гравиметрическая формы?
Рассмотрите на примере определения катионов серебра. Напишите уравнения реакций и рассчитайте гравиметрический фактор.
б)Для анализа взято 0.4328 г фосфорного удобрения. Масса прокаленного осадка пирофосфата магния Mg2P2O7 составила 0.1823 г. Вычислить массовую долю фосфора (Р) в удобрении.
199. а)Опишите операции гравиметрического анализа – высушивание и прокаливание осадков.
б)Масса прокаленного осадка BaSO4 составила 0.4128 г. Чему равна масса химически чистого FeS, из которой получен осадок BaSO4?
200. а)Что называется гравиметрическим фактором? Как он рассчитывается и какую роль играет в методе осаждения?
б) Вычислите массовую долю (%) гигроскопической воды в иодиде калия по следующим данным: масса тигля 4.4523 г; масса тигля с веществом 9.9727 г; масса бюкса с веществом после высушивания 9.9512 г.
ЛИТЕРАТУРА
1. Князев, Д.А. Неорганическая химия. / Д.А. Князев, С.Н. Смарыгин. М.: Юрайт, 2012. 598 с.
2. Хомченко, Г.П. Неорганическая химия. / Г.П. Хомченко, И.К. Цитович. СПБ: ИТК ГРАНИТ, 2009. 464 с.
3. Глинка, Н.Л. Общая химия: учебное пособие для вузов. / Н.Л. Глинка. М.: Интеграл-Пресс, 2010. 728 с.
4. Лидин, Р.А. Химические свойства неорганических веществ. / Р.А. Лидин, В.А. Молочко, Л.А. Андреева. М.: Колосс, 2008. 480с.
5. Литвинова, Т.Н. Сборник задач по общей химии. / Т.Н. Литвинова. М.: Оникс. Мир и образование, 2007. 223 с.
6. Хомченко, И.Г. Общая химия. / И.Г. Хомченко. М.: Новая волна, 2011.
464 с.
7. Глинка, Н.Л. Задачи и упражнения по общей химии. / Н.Л. Глинка. М.: Интеграл-Пресс, 2009. 240 с.
8. Цитович, И.К. Курс аналитической химии. / И.К. Цитович. М.: Лань, 2009. 495 с.
9. Власова, Е.Г. Аналитическая химия: химические методы анализа./ Е.Г. Власова; под ред. О.М. Петрухина, Л.Б. Кузнецовой. М.: Лаборатория знаний, 2017. 464 с.
10. Золотов, Ю.А. Введение в аналитическую химию. / Ю.А. Золотов. М.: Лаборатория знаний, 2016. 263 с.
11. Моногарова , О.В. Аналитическая химия. Задачи и вопросы. Учебное пособие. / О.В. Моногарова, С.В. Мугинова, Д.Г. Филатова; под ред. Т.Н. Шеховцовой. М.: ГЕОТАР-Медиа, 2016. 112 с.
12. Волков, А.И. Справочник по аналитической химии. / А.И. Волков, И.М. Жарский. Минск. ООО «Литера Гранд», 2014. 320 с.
13. Хаханина, Т.И. Аналитическая химия. / Т.И. Хаханина, Н.Г. Никитина. М.: Издательство Юрайт, 2016. 278 с.
ПРИЛОЖЕНИЯ
Таблица 1
Плотность (ρ) и концентрация (ω)
водных растворов некоторых веществ (20º С)
| ρ, г / см3 | ω, % | ρ, г / см3 | ω, % | ρ, г / см3 | ω, % | ρ, г / см3 | ω, % |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Натрий хлорид | |||||||
| 1,0053 | 1 | 1,0559 | 8 | 1,1162 | 16 | 1,1640 | 22 |
| 1,0125 | 2 | 1,0707 | 10 | 1,1319 | 18 | 1,1804 | 24 |
| 1,0268 | 4 | 1,0857 | 12 | 1,1478 | 20 | 1,1972 | 26 |
| 1,0413 | 6 | 1,1009 | 14 | ||||
| Соляная кислота | |||||||
| 1,0032 | 1 | 1,0574 | 12 | 1,1083 | 22 | 1,1593 | 32 |
| 1,0082 | 2 | 1,0675 | 14 | 1,1187 | 24 | 1,1691 | 34 |
| 1,0181 | 4 | 1,0776 | 16 | 1,1290 | 26 | 1,1789 | 36 |
| 1,0279 | 6 | 1,0878 | 18 | 1,1392 | 28 | 1,1885 | 38 |
| 1,0376 | 8 | 1,0980 | 20 | 1,1493 | 30 | 1,1980 | 40 |
| 1,0474 | 10 | ||||||
| Азотная кислота | |||||||
| 1,0036 | 1 | 1,1026 | 18 | 1,2205 | 36 | 1,3219 | 52 |
| 1,0091 | 2 | 1,1150 | 20 | 1,2335 | 38 | 1,3336 | 54 |
| 1,0201 | 4 | 1,1276 | 22 | 1,2463 | 40 | 1,3449 | 56 |
| 1,0312 | 6 | 1,1404 | 24 | 1,2591 | 42 | 1,3560 | 58 |
| 1,0427 | 8 | 1,1534 | 26 | 1,2791 | 44 | 1,3667 | 60 |
| 1,0543 | 10 | 1,1666 | 28 | 1,2847 | 46 | 1,3769 | 62 |
| 1,0661 | 12 | 1,1800 | 30 | 1,2975 | 48 | 1,3866 | 64 |
| 1,0781 | 14 | 1,1934 | 32 | 1,3100 | 50 | 1,3959 | 66 |
| 1,0903 | 16 | ||||||
| Серная кислота | |||||||
| 1,0051 | 1 | 1,1862 | 26 | 1,4148 | 52 | 1,6810 | 76 |
| 1,0118 | 2 | 1,2023 | 28 | 1,4350 | 54 | 1,7043 | 78 |
| 1,0250 | 4 | 1,2185 | 30 | 1,4557 | 56 | 1,7272 | 80 |
| 1,0385 | 6 | 1,2349 | 32 | 1,4768 | 58 | 1,7491 | 82 |
| 1,0522 | 8 | 1,2515 | 34 | 1,4983 | 60 | 1,7693 | 84 |
| 1,0661 | 10 | 1,2684 | 36 | 1,5200 | 62 | 1,7872 | 86 |
| 1,0802 | 12 | 1,2855 | 38 | 1,5241 | 64 | 1,8022 | 88 |
| 1,0947 | 14 | 1,3028 | 40 | 1,5646 | 66 | 1,8144 | 90 |
| 1,1094 | 16 | 1,3205 | 42 | 1,5874 | 68 | 1,8240 | 92 |
| 1,1243 | 18 | 1,3384 | 44 | 1,6105 | 70 | 1,8312 | 94 |
| 1,1394 | 20 | 1,3569 | 46 | 1,6338 | 72 | 1,8355 | 96 |
| 1,1548 | 22 | 1,3758 | 48 | 1,6574 | 74 | 1,8361 | 98 |
| 1,1704 | 24 | 1,3951 | 50 | ||||
| Уксусная кислота | |||||||
| 1,006 | 5 | 1,033 | 25 | 1,058 | 50 | 1,066 | 90 |
| 1,013 | 10 | 1,038 | 30 | 1,064 | 60 | 1,050 | 100 |
| 1,020 | 15 | 1,044 | 35 | 1,069 | 70 | ||
| 1,026 | 20 | 1,049 | 40 | 1,070 | 80 | ||
|
из
5.00
|
Обсуждение в статье: Примеры решения задач по теме « Гравиметрический анализ» |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

