 |
Главная |
Химизм ионного процесса.
|
из
5.00
|
На основании проведенных исследований сделана попытка объяснения химизма происходящих процессов на дифосфатах Fe,Co,Ni(II).Процесс ионообмена в данном случае протекает по двум механизмам: по обменному и комплексообразованию. Обменный механизм характерен для ионов Fe(II), т.к. их ионные радиусы близки к сорбируемому иону Mn2+ [28].
Ионные радиусы
| Вид иона | Радиус, нм |
| Mn2+ | 0,091 |
| Fe2+ | 0,080 |
| Co2+ | 0,078 |
| Ni2+ | 0,074 |
химически это можно выразить следующими уравнениями:
Fe2P2O7 + MnSO4 · 5Н2О = Mn2 P2O7 + FeSO4 + 5Н2О
Предположение об обменном механизме подтверждается экспериментальными данными атомно-абсорбционного анализа, содержание ионов Fe(II) в жидкой фазе после сорбции резко увеличивается, что говорит об их переходе в раствор. Чего нельзя сказать об ионах Ni и Co, содержание которых в жидкой фазе весьма невысокое (табл.6)
Таблица 6
Содержание иона марганца ( II ) после сорбции, %
| вещество | в твердой фазе | в растворе |
| Ni2P2O7 | 77,2% | 22,5 % |
| Co2P2O7 | 43,4% | 56,5 % |
| Fe2P2O7 | 26,6% | 73,3 % |
Атом Ni имеет следующую конфигурацию внешних электронных уровней: d8s0 , и способен к dsp2 гибридизации, за счет спаривания электронов на предвнешнем уровне может образовывать стабильные комплексы, с координационным числом равным 4, вероятно по следующей схеме:
Ni2P2O7 + MnSO4 · 5Н2О = Mn[NiP2O7] + NiSO4 + 5Н2О
Предположительно образуется два вида комплексов: а) Mn [ NiP 2 O 7]

 Mn
Mn
 |  |
O O
|| ||
О – Р – О – Р – O
 | |
| |
O O


Ni
б) Ni 2 P 2 O 7 · Mn ( OH )2

 O
O
||

 HO O – P – O OH
HO O – P – O OH

 \ | /
\ | /

 Mn O Mn
Mn O Mn

 / | \
/ | \
 O O – P – O O
O O – P – O O
 ||
||
O
Ni
Вторая структура имеет в своем составе (ОН) группы, по данным ИКС. При этом по данным РФА твердая фаза после сорбции перешла в аморфное фазу, что видно на рисунке 16.
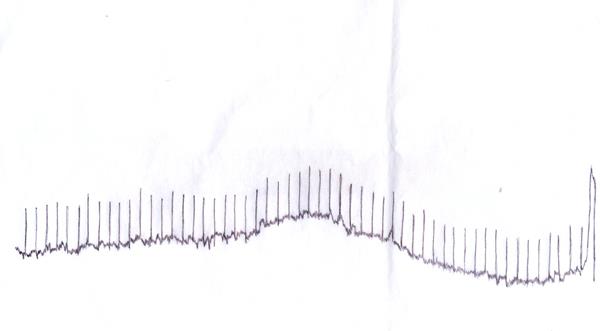
Рисунок 16. Рентгенограмма Ni2P2O7 после сорбции
На ИК-спектре (Рис.17) наряду с полосами поглощения (РОР), (РО3), (РО) группами обнаружена полоса поглощения (ОН) группы, в области диапазона 3300 см-1.
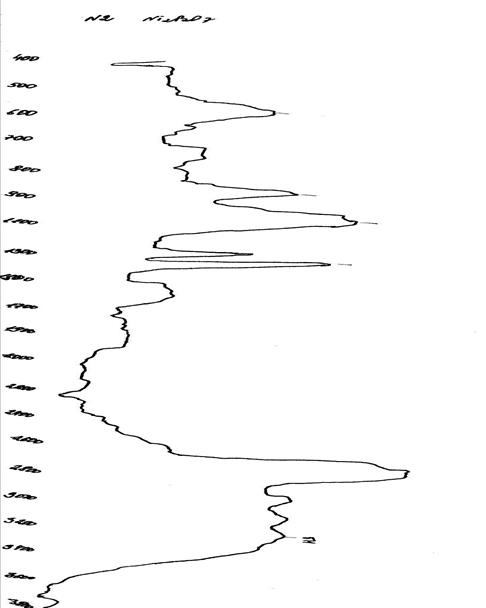
Рисунок 17. ИК-спектр Ni2P2O7 после сорбции
Строение внешних уровней иона кобальта отличается, он имеет нечетное количество d-электронов (d7s0), но в тоже время внешний уровень иона марганца также с нечетным числом электронов (d5s0), предположительно, взаимодействуя при комплексообразовании эти два иона образуют металл – металл связь Сo-Mn. Однако, по данным РФА, после сорбции основные соли (дифосфаты) являются самостоятельной фазой, т.к. процесс сорбции проходит не полностью их линии присутствуют в спектре, они находятся в одной области с образовавшейся новой фазой, подавляя друг друга, что затрудняет их идентификацию. Процесс ионообмена с кобальтом проходит частично по ионному механизму и частично с комплексообразованием, ионный радиус никеля меньше и тем самым его способность к компелксообразованию.
Выводы
1. Синтезированы и индетифицированы методами ИК-спектроскопии, РФА, химическими методами исследования конденсированные фосфаты цинка, железа, кобальта, никеля (Zn2P2O7, Fe2P2O7, Ni2P2O7, Co2P2O7).
2. Установлены зависимости сорбции ионов Mn(II) на полимерных фосфатах. Циклотетрафосфат железа не сорбирует ионы, из изученных дифосфатов Ni2P2O7 проявляет максимальную степень поглощения равную 98,5%.
3. Предложен химизм процесса сорбции ионов марганца дифосфатами железа, кобальта, никеля (Zn2P2O7, Fe2P2O7, Ni2P2O7, Co2P2O7), который происходит для Zn2+, Fe2+ по ионным механизмам, а Co2+, Ni2+ по комплексообразованию.
Использованная литература:
1. Куанышева Г.С., Макашева Г.Р., Джамансариева К.У. «Химия и основы модифицирования конденсированных фосфатов». Метод.пособие. Алматы, 2002г., 33 с.
2. Ван Везер «Фосфор и его соединения» М.: Изд.Инлит. 1962г. – 245 с.
3. Физико – химические исследования мнонмерных и полимерных фосфатов. Издательство Наука» Казахской СССР, А., 1987г.
4. Жданов Ю.В. «Химия и технология полифосфатов» - М.: Химия, 1979г., - 185 с.
5. Виноградова Н.В., Бондарь И.А., Демьянец Л.Н. и др. «Соединения редкоземельных элементов. Силикаты, германаты, фосфаты, арсенаты, ванадаты» М.: Наука, 1983г., - 122 с.
6. Корбридж Д. «Фосфор. Основы химии, биохимии, технологии» М.: Мир, 1982г. -с.119-125
7. Е.Е.Ергожин, М.К.Курманалиев Методическая разработка к спецпрактикуму «Иониты и ионный обмен», А., изд. КазГУ, 1988г., 37с.
8. Ключников Н.Г. «Руководство по неорганическому синтезу» - М.: Издательство «Химия»1965г.-311 с.
9. Ю.А Кокотов «Иониты и ионный обмен», Ленинград Химия, 1980. с. 100-106.
10. Ю.А. Кокотов, В.А.Пасечкин «Равновесие и кинетика ионного обмена» М.: Химия, 1970г., с.35-45
11. Куанышева Г.С., Макашева Г.Р. Методические указания к спецкурсу «Химия фосфорных удобрений». Алматы, КазГУ, 1989г. – с.6-20
12. Куанышева Г.С., Джамансариева К.У., Сдикова Г.Ж. «Термодинамические характеристики дифосфатов 3d-элементов» Вестник КазНУ, Сер. хим., 2005г, №2 (38), с.71-74
13. Е.Е.Ергожин «Высокопроницаемые иониты» А.: Наука, 1979г.
14. Констант З.А., Диндуне О.В. «Фосфаты двухвалентных металлов» Рига, Зинатне 1987г.- с.103-108
15. К.М.Солдадзе, В.Д.Копылова «Комплексообразующие иониты», М.: «Химия», 1980г. 220с.
16. М.Мархол «Ионообменники в аналитической химии», М.: Мир, 1985г., часть 1,2 с.25-190
17. Ч. Амфлетт «Неорганические иониты», М., Химия, 1966г. с. 85-95
18. Н.Г.Полянский, Г.В.Горбунов «Методы исследования ионитов», М.: Наука, 1976г., с.35-41
19. Е.Е.Ергожин, Е.Ж.Менлигазиев «Полифункциональные ионообменники» А.: Наука, 1986г.
20. Л.В.Зубанова, А.С.Тевлина, А.В.Даванков «Синтетические ионообменные материалы» - М.: Химия, 1973г.
21. Н.М.Селиванова, Н.Ю. Морозова, Л.Х.Кравченко, Т.И.Хожаинова «Термическая стойчивость пирофосфата цинка Zn2Р2О7 · 5Н2О» Журнал неорган. Химии, 1975г., том 20, вып.3.
22. Krishnamachari N., Calvo C. The crystal structure of cobalt diphospate. – Acta Crystallogr. Sect.B, 1972, vol. 28B, N 9, p. 2883-2885.
23. Пахомов В.И. Некоторые вопросы кристаллохимии кислородных неорганических соединений фосфора (V). – Изв. АН СССР. Неорганич. материалы, 1977г., т. 13, № 8, с.1341-1352.
24. В.А.Урих, Третье всесоюзное совещание по фосфатам (тезисы), 3, Зинатне, Рига, 1971г., стр. 488-489.
25. А.Б.Бектуров, В.А.Урих, В.В.Тихонов, Д.З.Сератдезинов, В.А.Синяев, Известия АН СССР, Неорганическая материалы, 8, №2, 303, 1972г.
26. Lukaszewicz K. Crystal structure of α - Ni2P2O7. Bull.Acad.Pol.Sci., 1967, Vol.15, №2, р.47-51
27. Тетеревков А.И., Печковский В.В. «Особенности термической диссоциации FePO4» - ДАН БССР, 1974, т.18, № 5, с. 442-444.
28. «Краткий справочник физико-химических величин» Изд.8-е, перераб. Под ред. А.А.Равделя и А.М.Пономаревой. Л.: Химия, 1983г.: - 232 с.
29. Недома А. «Расшифровка рентгенограмм порошков».-Металлургия, 1975г., - 230 с.
30. Спицын В.И., Мартыненко Л.И. «Неорганическая химия», часть І, 1991г., - 245 с.
31. Щегров Л.Н. «Фосфаты двухвалентных металлов». Киев – Наукова думка. 1987г. –112 с.
32. Виноградов А.П. «Геохимия редких и рассеянных химических элементов в почвах» М.: Изд-во АН СССР, 1957г., - 218 с.
33. Бабенко Г.А. «Микроэлементы в сельском хозяйстве и медицине» К., 1963; - 125с.
34. Куанышева Г.С., Джамансариева К.У., Сдикова Г.Ж. «Изучение кинетики гидролитической деструкции дифосфатов 3d-элементов» Вестник КазНУ, Сер. хим., 2005г, №3 (39), с.156-159
35. Куанышева Г.С., Джамансариева К.У., Балгышева Б.Д., Макашева Г.Р. «Закономерности гидролитического расщепления линейных фосфатов s-элементов», Хабаршы вестник, 2002г. №3 (27), с.133-137
36. Тезисы и докладов 60-ой Республиканской научно-практической конференции молодых ученых и студентов по прикладным вопросам химии «Гидролитическая устойчивость циклотетрафосфатов 3d-элементов» Алматы, 2006г., 8с.
37. Ковальский В.В. «Геохимическая экология». М.: Наука, 1974., -195с.
38. Школьник Я., «Значение микроэлементов в жизни растений и в земледелии» Л., 1950г., - 251с.
39. Щегров Л.Н., Антрапцева Н.М. «Изучение взаимодействия смеси растворов сульфата цинка и кобальта с двухзамещенным фосфатом аммония», Журн.неорг.химии,1983г., 28 №10. с.2523-2528
40. Щегров Л.Н.«Образование двойных однозамещенных ортофосфатов Zn - Со», Укр.хим.журнал,1984, 50 №8. с.807-812.
41. С.М.Романова, З.С.Мусарипова, С.С.Крученко «Сорбция ионов марганца (II) гидроксидами железа и алюминия», Вестник КазГУ сер. Химическая, №3(15), А.: «Қазақ университеті», 1999г.
42. Бруцкус Е.Б., / тр. НИУИФ., т.137. с.101
43. Технология фосфорных и комплексных удобрений. М.: Химия, 1987г.
44. Маркина Т.Д. «Водные фосфаты алюминия, железа и хрома» Диссертация – Симферополь.
45. Сидоренко И., Журавлева Е.Д., Фордиенко В.И., Гринева Л.П., «Исследование комплексообразования ионов Fe3+ с фосфорной кислотой» ЖНХ., 1973. Т.18 В.5. с.:1270-1273
46. Филлатова Л.Н. «Комплексообразования железа (ІІІ) в концентрированных ортофасфатных растворах» ЖНХ., 1974. Т.19. В19. с.3064-3066
47. Rossee T., Kiesslich H. Chamatagraphisce analyse von phosphaten. /Anal. Chem.., 1976., p. 391-402.
48. «Атлас ИК-спектров фосфатов Моно-, дифосфаты, метафосфаты» под ред. Печковского В.В., М., Химия, 1971. с.: 248-256
49. Накамато К., «Инфракрасные спектры неорганических и координационных соединений», М.: Мир, 1966г.
50. Цымбал Е.П. «Физико-химическое исследование аморфной гидроокиси железа, осажденной водных и неводных растворов» Автореферат. Саратов, 1972г.
|
из
5.00
|
Обсуждение в статье: Химизм ионного процесса. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

