 |
Главная |
Экспериментальная часть.
|
из
5.00
|
2.1. Характеристика исходных веществ. Методика химических и физико-химических методов исследования.
В работе были использованы в качестве исходного сырья:
1. CoСО3
2. К4P2O7
3. Fe2O3
4. NH4Н2PO4
5. MnSO4 · 5H2O
6. NiSO4· 6H2O
Все вещества были взяты марки «ч.д.а.»
Для проведения химического анаиза применялись следующие реактивы [6]:
1) Азотная кислота, HNO3, конц., разбавленная 1:2;
2) Метаванадат аммония, NH4VO3, 0,25%-ный раствор;
3) Молибдат аммония, (NH4)6Mo7O24· 4H2O, 5%-ный раствор;
4) Реактив на фосфаты;
5) Стандартный раствор дигидрофосфата калия, реактив А (KH2PO4);
6) Лимонная кислота, 2%.
Все вещества были взяты марки «ч.д.а.»
Для определения пентоксида фосфора применялись методика, принятая при анализе удобрений [6].
Химический состав катионов (содержание Ni2+, Со2+, Fe2+) определяли методом атомно-адсорбционного анализа.
Фазовый состав синтезированных соединений определялся снятием рентгенограмм на дифрактометре ДРОН-05 с использованем медного излучателя.
ИК спектры поглощения записывали в диапозоне 4000 – 500 см-1 с помощью спектрофотометра Sресоrd, используя для съемки образцы (0,5 масс.%) в виде таблеток КВr.
Фотоколориметрический метод определения Р2О5.
Реактивы: серная кислота, отн.пл. 1,84 г/см3; соляная кислота - 20%-ный раствор; азотная кислота, отн.пл. 1,4 г/см3 и разбавленная 1:2.
Метаванадат аммония (0,25%-ный раствор) – взвешивают 2,5г NH4VO3 с точностью до 0,01г, растворяют в 500мл горячей воды, приливают 20 мл азотной кислоты, отн.пл. 1,4 г/см3, доводят объем до 1л и фильтруют.
Молибдат аммония (5 %-ный раствор) – взвешивают 50г (NH4)6Mo7O24· 4H2O с точностью до 0,01г, растворяют в 500 мл воды при 500С; после охлаждения доводят объем до 1л и фильтруют.
Реактив на фосфаты: смешивают равные объемы растворов азотной
кислоты 1:2, метаванадата аммония и молибдата аммония;
Стандартный раствор дигидрофосфата калия, реактив А (растворяют 1,9175г КН2РО4 в дистилированной воде в мерной колбе на 1л , прибавляют 10 мл серной кислоты отн.пл. 1,84 г/см3, доводят объем водой до метки и перемешивают; в 1 мл раствора А содержится 1 мг Р2О5).
Построение калибровочного графика.
В шесть мерных колб вместимостью 100мл вводят микробюреткой 1, 2, 3, 4, 5, 6 мл раствора дигидрофосфата калия, что соответствует 1, 2, 3, 4, 5, 6 мг Р2О5. Объем раствора в каждой колбе доводят до 20 мл водой, добавляют 25мл реактива на фосфаты (А), разбавляют до метки водой и через 5 мин. Измеряют оптическую плотность относительно раствора сравнения, содержащего 1 мг Р2О5. Калибровочный график периодически проверяют по трем точкам, например 1,5; 1,75; 2,0 мг Р2О5. Измерения на калориметре следует проводить при температуре воздуха от 10 до 350С.
Рабочие поверхности кювет перед каждым измерением необходимо тщательно протирать спирто-эфирной смесью. Жидкость в кюветы наливают до метки на боковой поверности кюветы. При установке кювет в кюветодержатели нельзя касаться пальцами участков поверхностей ниже уровня жидкости в кювете.
Колориметр включают в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемником и перекрывает световой пучок). В световой пучок помещают кювету со стандартным раствором, по отношению к которому производятся измерения, и крышку кюветного отделения закрывают. Измерения проводят 3-5 раз и окончательное значение измереной величины определяют как среднее арифматическое из полученных значений.
Ход анализа.
В мерную колбу вместимостью 100 мл отбирают объем фильтрата (фильтрат получают также как и при определения Р2О5 весовым методом), соответствующий 0,7-1,75 мг Р2О5 и разбавляют водой до 20 мл. Затем добавляют 25 мл реактива на фосфаты, разбавляют до метки водой. Далее анализ продолжают, как при определения калибровочной кривой.
Расчет.
Содержание Р2О5 – в массовых долях в % (ω Р2О5) вычисляют по формуле:
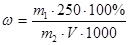 , где
, где
m1 – масса Р2О5, найденная по калибровочному графику, мг;
m2 – масса анализируемого вещества, г;
V – объем растворы, взятой на анализу, мл.
2.2. Синтез дифосфатов Со, Ni и Fe и их характеристика.
Дифосфат кобальта светло-фиолетового цвета получен в системе СоО – Р2О5 при нагревании смеси СоО (СоСО3) и NН4Н2PO4 до 10000 и выше при соотношении СоО : Р2О5 = 2:1.
2СоСО3 + 2NН4Н2PO4 → Со2Р2О7 + + 2NН3 + 2СО2 + 3Н2O
Для Со2Р2О7 известны низко- и высокотемпературная модификации, взаимопереход между которыми, осуществляется при 295-3000С. Теплота модификационного перехода оценивается величиной (7,1±0,8) кДж/моль [22, 39].
Структура низкотемпературной формы α - Со2Р2О7 показывает, что угол между связами Р – О – Р = 142,60 [39].Несимметричное строение группы Р2О7 связывается с различным окружением тетраэдров РО4 катионами: первый тетраэдр окружен пятью ионами кобальта, второй – шестью. Высокотемпературная форма β - Со2Р2О7 (как и дифосфаты Ni, Mn, Zn, Mg) изоморфна минералу тортвейтиту. Группа Р – О – Р в этой форме дифосфата кобальта имеет линейное строение, причем а0 и с0 вдвое меньше по сравнению с низкотемпературной формой [40].
Фосфаты железа представляют интерес в качестве возможных компонентов высокотемпературных фосфатных связок и бетонов. Известно, что мета-, пиро- и ортофосфаты щелочных, щелочноземельных и некоторых переходных металлов при высоких температурах диссоциируют с отщеплением Р2О5. В связи с изложенным представляло интерес исследовать поведение FePO4 при нагревании [27].
FePO4 при высоких температурах частично диссоциирует по уравнению:
2FePO4 = Fe2P2O7 + 0,5О2.
Следовательно, в отличие от фосфатов, щелочных, щелочноземельных и других переходных металлов, которые диссоциируют с отщеплением Р2О5, средний ортофосфат железа (III) при нагревании до 1100 – 12000 частично диссоциирует с отщеплением кислорода и превращается при этом в пирофосфат Fe2P2O7 [31, 36].
Дифосфат никеля синтезирован при смешивании эквимолярных растворов Na4P2O7 и NiSO4. Осадок очищали перекристаллизацией из водного раствора насыщенного SO2 [14]. Дифосфат никеля относится к типу тортвейтита и изоструктурен Mg2Р2О7. При синтезе соединений в системе NiO и Р2О5 и соотношении Р/Ni = 0,8 – 1,2. Также установлены эти формы дифосфата с различными показателями преломления [26].
2NiSO4 + Na4P2O7 → Ni2P2O7 + 2Na2SO4
|
из
5.00
|
Обсуждение в статье: Экспериментальная часть. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

