 |
Главная |
Лабораторная работа №2
|
из
5.00
|
Метод определения железа
Цель работы: изучить метод фотоколориметрическогоопределения железа.
Сущность метода заключается в том, что ионы трехвалентного железа образуют с сульфосалицилат-ионами комплексное соединение, раствор которого в щелочной среде окрашен в желтый цвет. Двухвалентное железо в условиях анализа переходит в трехвалентное.
Все фотоколориметрические методы определения основаны на одном общем принципе. Световой поток проходит через кювету наполненную испытуемым окрашенным раствором. Прошедший через раствор световой поток воспринимается фотоэлементом, в котором световая энергия превращается в электрическую энергию. Возникающий при этом электрический ток измеряют при помощи чувствительного гальванометра. Сила электрического тока, возникающего при действии световой энергии на фотоэлемент, прямо пропорциональна интенсивности освещения.
Для определения этим методом концентрации исследуемого вещества измеряют оптическую плотность испытуемого раствора (Dисп) и эталонного раствора, концентрация которого известна (Dэтал). Расчет проводят по формуле:
Сисп = (Dисп/ Dэтал)∙Сэтал
Основными преимуществами фотоколориметрических методов измерения интенсивности окраски является быстрота и легкость определений при высокой их точности.
Химический процесс. Железо образует два ряда солей: соли железа (II) и (III). Растворы солей железа (III) содержат трехзарядные катионы Fe3+, а растворы солей железа - двухзарядные катионы Fe2+. Так как реакции этих ионов совершенно различны, нужно рассматривать их отдельно.
Растворы солей железа (III) имеют желтую или красно-бурую окраску (в зависимости от образующегося комплекса). Комплексы образуются в результате соединения между собой электрически нейтральных молекул более простых по составу солей.
Экспериментальная часть
Приготовление растворов
1. Раствор аммония хлористого, 2 моль/дм3.
26,75 г аммония хлористого растворяют дистиллированной водой в мерной колбе на 250 см3. Объем доводят до метки дистиллированной водой.
2. Аммиак разбавленный 1:1.
В мерную колбу на 250 см3 приливают 125 см3 дистиллированной воды, затем приливают 125 см3 водного аммиака 22%. (раствор готовят под вытяжкой).
3. Кислота сульфосалициловая, 300 г/дм3.
30 г сульфосалициловой кислоты растворяют дистиллированной водой в мерной колбе на 100 см3. Объем доводят до метки дистиллированной водой.
4. Кислота соляная 1:1.
В мерную колбу на 100 см3 приливают 50 см3 дистиллированной воды, затем приливают
см3 концентрированной соляной кислоты (раствор готовят под вытяжкой).
5. Основной стандартный раствор железа, 1мг/см3 ГОСТ 4212-76.
6. Рабочий стандартный раствор, 10мкг/см3.
1 см3 основного стандартного раствора помещают в мерную колбу вместимостью 100 см3 и доводят объем раствора до метки дистиллированной водой.
Проведение анализа
Объем исследуемого раствора, содержащий 10-100 мкг железа, помещают в коническую колбу, добавляют 1 см3 раствора соляной кислоты (1:1) и упаривают до объема 10-15 см3. Полученный раствор разбавляют дистиллированной водой и фильтруют, собирая фильтрат в мерную колбу вместимостью 100 см3, добавляют 2 см3 раствора хлористого аммония (2 моль/дм3), 2 см3 раствора сульфосалициловой кислоты (300г/дм3) и 5 см3 аммиака (1:1). Объем раствора доводят дистиллированной водой до метки и перемешивают. Через 5 мин. делают замер пробы на КФК-2. В качестве раствора сравнения применяют дистиллированную воду.
Обработка измерений
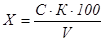
где:
Х - массовая концентрация железа в исследуемой пробе, мг/дм3;
С - массовая концентрация железа, найденная по градуировочному графику, мг;
К - коэффициент перерасчета на мг/дм3;
V - объем пробы взятый для анализа, см3;
Контрольные вопросы
1. На каком общем принципе основаны методы фотоколориметрического анализа?
2. Как определяется оптическая плотность раствора?
. В чем заключается сущность фотоколориметрического определения железа?
. Перечислите основные преимущества этого метода.
. Какое комплексное соединение образуют ионы трехвалентного железа с
сульфасалицилат-ионом?
. В какой цвет образующийся комплекс окрашивает раствор, и какой при этом должна быть среда?
7. В чем заключается сущность методики построения калибровочного графика?
. Какую зависимость отражает калибровочная кривая?
Лабораторная работа № 3
|
из
5.00
|
Обсуждение в статье: Лабораторная работа №2 |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

