 |
Главная |
Сравнение свойств бензола со свойствами алкенов
|
из
5.00
|
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него характерна тенденция вступать в типичные для алкенов реакции присоединения. Однако в условиях, в которых алкен быстро вступает в реакции присоединения, бензол не реагирует или реагирует медленно (табл. 1.1).
Бензол не вступает в реакции присоединения, в которых разрушилась бы p-электронная система бензольного кольца. Такая устойчивость называется кинетической. Она связана со значительной энергией активации для реакции присоединения. Чем больше кинетическая устойчивость, тем больше энергия активации и меньше константа скорости.
Таблица 7.1
Сравнение химических свойств циклогексена и бензола
| Реагент | Циклогексен 
| Бензол 
|
| Результат взаимодействия | ||
| KMnO4 (разбавленный водный раствор) | Быстро окисляется | Не реагирует |
| Вг2 (CCl4, в темноте) | Быстро присоединяет | Не реагирует |
| НВr | Быстро присоединяет | Не реагирует |
| Н2 (Ni) | Быстро гидрируется (25 оС; 0,14 МПа) | Медленно гидрируется (200 оС; 10,5 МПа) |
Вместе с тем бензол достаточно легко вступает в реакции замещения. Образующиеся при этом продукты сохраняют специфическую структуру бензола. Таким образом, химические свойства бензола свидетельствуют о необычной стабильности бензола.
Теплота гидрирования. Энергия резонанса
Теплота гидрирования - это количество теплоты, выделяющейся при гидрировании 1 моль ненасыщенного соединения. Теплота гидрирования циклогексена равна 121 кДж/моль.

Можно ожидать, что теплота гидрирования 1,3,5-циклогексатриена, содержащего три простые и три независимые двойные связи (гипотетический 1,3,5-циклогексатриен), будет равна утроенной теплоте гидрирования циклогексена: 121·3 = 363 кДж /моль.

Однако экспериментальная теплота гидрирования бензола составляет 209 кДж/моль, что на 154 кДж/моль меньше расчетной (рис. 7.1).

Рис. 7.1. Энергия резонанса бензола, вычисленная на основе теплот гидрирования
Бензол выделяет при гидрировании энергии на 154 кДж/моль меньше, чем было предсказано на основе гипотезы о наличии трех независимых двойных связей. Следовательно, бензол беднее энергией, чем гипотетический 1,3,5-циклогексатриен. Эта энергия называется энергией резонанса. Она определяет термодинамическую устойчивость бензола.
Строение бензола
Согласно теории резонанса, в любом случае, когда строение молекулы может быть изображено несколькими структурами, отличающимися только распределением электронов, ни одна из этих структур не адекватна рассматриваемой молекуле. Молекула представляет собой резонансный гибрид этих структур, называемых граничными. Каждая из граничных структур вносит свой вклад в гибрид: чем устойчивее структура, тем больше ее вклад.
Бензол представляет собой резонансный гибрид двух равноценных граничных структур: (I) и (II).
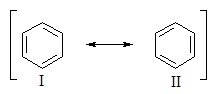
Изображение бензола в виде двух структур вовсе не предполагает их существование. Это означает, что строение бензола не может быть изображено ни структурой (I), ни структурой (II). Бензол имеет строение, промежуточное между ними. Поскольку граничные структуры (I) и (II) эквивалентны, их вклад в резонансную структуру одинаков. Бензол устойчивее, чем любая из граничных структур, на 154 кДж/моль.
Каждый атом углерода в молекуле бензола находится в sp2-гибридном состоянии и связан тремя s-связями с двумя атомами углерода и одним атомом водорода. Атомы углерода и водорода лежат в одной плоскости.

Четвертый валентный электрон атома углерода находится на 2р-орбитали, перпендикулярной плоскости молекулы. Эти 2р-орбитали состоят из двух одинаковых долей, одна из которых лежит выше, другая - ниже плоскости кольца; 2р-орбиталь каждого атома углерода перекрывается с 2р-орбиталями обоих соседних атомов углерода. В результате образуется замкнутая шести-p-электронная система в виде двух “бубликов”, один из которых лежит выше, а другой - ниже плоскости правильного шестиугольника.

Рис. 7.2. Молекула бензола:
а - перекрывание 2р-орбиталей, образующих p-связи;
б - p-облака в виде двух "бубликов"
Благодаря коллективному взаимодействию всех шести p-электронов происходит выравнивание всех связей С–С по длине и кратности. Все связи углерод-углерод в молекуле бензола являются промежуточными между двойной и простой связями. Длина всех связей С–С в бензоле (13,9×10-2 нм) оказывается промежуточной между длиной двойной связи С=С в алкенах (13,4×10-2 нм) и расчётным значением длины простой связи С(sp2)–С(sp2), равным (14,8×10-2 нм).
Вторым следствием коллективного p-электронного взаимодействия является выигрыш энергии за счет резонанса структур (I) и (II), т.е. электронная и связанная с ней термодинамическая и кинетическая стабилизация бензола.
Ароматичность
Какие свойства должно проявлять вещество для того, чтобы его можно было отнести к ароматическим соединениям? Ароматичность можно определить с точки зрения кинетической устойчивости. Ароматическими называются соединения с молекулярной формулой, указывающей на высокую степень ненасыщенности, которые, однако, не реагируют как ненасыщенные соединения (кинетическая устойчивость), а вступают в реакции электрофильного замещения; для них характерна высокая термодинамическая устойчивость.
Условие ароматичности определяется правилом Хюккеля.
| Ароматическими свойствами обладает соединение, если его строение удовлетворяет следующим требованиям: 1) соединение включает в себя плоскую моно- или полициклическую структуру, 2) каждый цикл в этой структуре содержит замкнутую систему делокализованных p-электронов, 3) число p-электронов в цикле должно равняться (4n+2), где n= 0, 1, 2, ...(целое число). |
Для n=1 число сопряженных p-электронов в ароматической системе равно шести. В бензоле как раз имеется циклическая шести-p-электронная система - ароматический секстет. Таким образом, бензол отвечает правилу Хюккеля.
Физические свойства
Физические свойства аренов похожи на свойства углеводородов других классов. Арены представляют собой малополярные соединения, плохо растворимые в воде, но растворимые в неполярных и слабополярных растворителях: гексане, эфире, четыреххлористом углероде.
Температура кипения аренов несколько выше, чем температура кипения углеводородов жирного ряда с тем же числом атомов углерода.
Температура кипения алкилбензолов растёт с увеличением молекулярной массы так же, как и в ряду алканов. Увеличение температуры кипения за счёт удлинения алкильной линейной цепочки на один атом углерода составляет 20-30 ºС. Разветвлённые алкилбензолы кипят при более низкой, а плавятся при более высокой температуре, чем их изомеры с линейной углеродной цепью.

| 
|
| н-Бутилбензол Ткип = 183 оС Тпл = -81 оС | трет-Бутилбензол Ткип = 169 оС Тпл = -58 оС |
Температуры кипения мета- и пара-изомеров диалкилбензолов приблизительно одинаковы, а температура кипения орто-изомера на несколько градусов выше. Плавление сопровождается разрушением межмолекулярных сил в кристалле; более симметричные молекулы более плотно упаковываются в кристаллической решетке. Чем прочнее кристаллическая решетка, тем выше температура плавления. Поэтому для дизамещенных производных бензола характерна такая закономерность: температура плавления наиболее симметричного пара-изомера обычно превышает температуры плавления менее симметричных орто- и мета-изомеров (см. табл. 7.2). Высокой степенью симметрии обладает бензол. Его температура плавления достаточно высока - плюс 5 оС.
Вследствие того, что растворение, так же как и плавление, связано с разрушением кристаллической решетки, пара-изомер менее растворим, чем орто- и мета-изомеры диалкилбензолов.
Для аренов характерны высокие значения показателя преломления (см. табл. 7.2). Это является следствием сопряжения p-электронов и повышенной поляризуемости сопряжённой p-электронной системы ароматического ядра. Особенно большое значение показателя преломления у стирола, так как в нем с p-электронами ароматического кольца дополнительно сопряжена винильная группа.
В ИК-спектрах аренов наблюдаются полосы поглощения валентных колебаний связей С–Н в ароматическом кольце с частотой 3000-3100 см-1. Они практически совпадают с аналогичными частотами n (=C–Н) в алкенах, что можно объяснить одинаковым электронным состоянием соответствующих связей.
Таблица 7.2
|
из
5.00
|
Обсуждение в статье: Сравнение свойств бензола со свойствами алкенов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

