 |
Главная |
Физические свойства аренов
|
из
5.00
|
| Название | Формула | Тпл, оС | Ткип, оС | Плотность | Показатель преломления |
| Бензол | 
| 5,5 | 80,0 | 0,879 | 1,5065 |
| Толуол | 
| -95,0 | 111,0 | 0,866 | 1,4961 |
| орто-Ксилол | 
| -25,0 | 144,0 | 0,880 | 1,5055 |
| мета-Ксилол | 
| -48,0 | 139,0 | 0,864 | 1,4972 |
| пара-Ксилол | 
| 13,0 | 138,0 | 0,861 | 1,4958 |
| Этилбензол | 
| -95,0 | 136,0 | 0,867 | 1,4959 |
| Стирол | 
| -31,0 | 145,0 | 0,907 | 1,5462 |
| н-Пропилбензол | 
| -99,0 | 159,0 | 0,862 | 1,4920 |
| Изопропилбензол (кумол) | 
| -96,0 | 152,0 | 0,862 | 1,4915 |
Моно-, а также различные орто-, мета- и пара-дизамещенные алкилароматические углеводороды можно различить по характерным для ароматических колец частотам поглощения внеплоскостных деформационных колебаний С–Н.
Монозамещенные 690 - 700 cм-1, 730 - 770 см-1.
орто-Дизамещенные только 735 - 770 см-1.
мета-Дизамещенные 690 - 710 cм-1, 750 - 810 см-1.
пара -Дизамещенные 810 - 840 см-1.
УФ-спектры углеводородов связаны с поглощением, вызывающим переходы электронов с высших связывающих орбиталей в невозбужденной молекуле на более высоко расположенные несвязывающие орбитали возбужденной молекулы. Легкость электронного перехода возрастает при увеличении степени сопряжения p-электронов. Например, для этилена полоса поглощения p-p*-перехода наблюдается при 185 нм, для I,3-бутадиена - при 217 нм, для бензола длинноволновая полоса поглощения (a-полоса) наблюдается при 256 нм, для толуола - 267 нм. Особенно значительное смещение полосы в длинноволновую область (батохромный сдвиг) в стироле (lmax = 278 нм).
Химические свойства
Для бензола характерны реакции замещения, в которых сохраняется устойчивая шести-p-электронная ароматическая система. Хотя p-электроны ароматического кольца в большей степени, чем p-электроны в алкенах, участвуют в связывании ядер углерода, они удерживаются все же слабее, чем s - электроны, и доступны для реагентов, любящих электроны - электрофилов. Следовательно, типичными реакциями аренов должны быть реакции электрофильного замещения (SE Ar).
Электрофильное замещение
Для аренов характерны следующие реакции электрофильного замещения

Нитрование
Азотная кислота очень медленно реагирует с бензолом. Для ускорения реакции нитрования бензола к азотной кислоте добавляют серную кислоту. Смесь концентрированных серной и азотной кислот называют нитрующей смесью.

Образование электрофильной частицы - нитроний-катиона NO2Å происходит в реакции между азотной и серной кислотами. Вначале образуется протонированная азотная кислота.

Эта реакция представляет собой кислотно-основное равновесие. Серная кислота является кислотой, а более слабая азотная кислота ведёт себя как основание, предоставляя пару электронов для образования связи с протоном. Протонированная азотная кислота распадается с образованием нитроний-катиона O2NÅ и молекулы воды.

Первая стадия нитрования начинается атакой положительно заряженным нитроний-катионом доступного p-электронного облака бензола с образованием p-комплекса p-К1 (рис. 7.3). Это комплекс между электрофилом и ароматическим субстратом, в котором ароматическое соединение выступает в роли донора электронов, а электрофил действует как акцептор электронов, при этом сохраняется сопряженная 6p-электронная система. Атом азота не соединен с каким-либо одним атомом углерода.
Вторая стадия - медленная - электрофил вытягивает из 6p-электронной системы пару электронов. За счёт этой пары электронов и происходит присоединение атома азота к атому углерода с образованием s-связи. Атакуемый атом углерода переходит из

Рис. 7.3. Энергетическая диаграмма нитрования бензола
sp2-гибридного состояния в sp3-гибридное состояние. Образуется карбокатион - s-комплекс. Название “s-комплекс” указывает на образование s-связи углерода кольца с азотом электрофильного реагента.
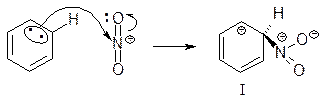
Каково строение s-комплекса? Оно не может быть показано структурой (I) с локализованными двойными связями и локализованным положительным зарядом. Строение s-комплекса должно быть изображено резонансным гибридом трёх граничных структур - (I), (II) и (III), которые отличаются только распределением электронов:

Четыре p-электрона сопряжённого карбокатиона - s-комплекса распределены между пятью атомами углерода, находящимися в sp2- гибридном состоянии, причём распределены неравномерно: наибольший дефицит электронной плотности (частичный положительный заряд) возникает в орто- и пара-положениях по отношению к углероду в sp3-гибридном состоянии, у которого происходит замещение (ни в одной граничной структуре в мета-положении нет положительного заряда). Такое неравномерное распределение положительного заряда в промежуточном карбокатионе имеет важное значение для выбора места вступления электрофильной частицы в ароматическое ядро, в котором уже имеется какая-либо группа.
Распределение электронной плотности, а следовательно, и положительного заряда между несколькими атомами углерода ядра, делает карбокатион достаточно устойчивым. Энергия сопряжения этой системы незначительно отличается от энергии сопряжения бензола и составляет 109 кДж/моль. Именно благодаря такой стабилизации возможно образование карбокатиона из очень устойчивой молекулы бензола.
Иногда строение s-комплекса изображают структурами

в которых дугой обозначены четыре p-электрона, распределённые между пятью атомами углерода.
Первая и вторая стадии электрофильного замещения в ароматическом ядре во всём подобны первой и второй стадиям электрофильного присоединения к алкенам.
Третья стадия – стабилизация карбокатиона. Карбокатион не присоединяет анион (нуклеофил), как это имеет место в случае электрофильного присоединения, а выбрасывает протон, отрыву его способствует основание НOSO2O¯. Третья стадия идёт по пути, который имеет более низкую энергию активации, и ведёт к образованию устойчивой ароматической структуры: протон, покидая карбокатион, оставляет пару электронов s-связи С–Н, которая вливается в четырёх-p-электронную систему, таким образом восстанавливается шести-p-электронная ароматическая система (см. рис. 7.4).

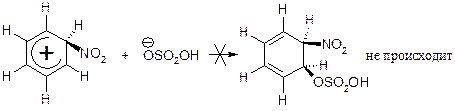

Рис. 7.4. Энергетическая диаграмма конкурирующих стадий
превращения s-комплекса
Представленный механизм электрофильного замещения в ароматическом ядре протекает как электрофильное присоединение с образованием s-комплекса (медленная скорость определяющая стадия) и последующее отщепление протона с образованием продукта реакции. Выброс протона может протекать через стадию образования еще одного p-комплекса p-К2 (рис. 7.3).
Галогенирование
Хлор и бром реагируют с бензолом в присутствии кислот Льюиса (AlCl3, FeCl3).

Электрофильная частица образуется в реакции галогена с катализатором. Эта реакция представляет собой кислотно-основное взаимодействие, продуктом которого является донорно-акцепторный комплекс (ДАК).
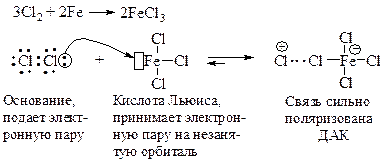
Внешний атом хлора становится достаточно электрононенасыщенным, чтобы атаковать бензольное ядро.
Стадия образования карбокатиона (s-комплекса).

Стадия стабилизации s-комплекса. Карбокатион теряет протон, восстанавливается ароматический секстет электронов.

Благодаря регенерации хлорида железа для реакции необходимо лишь каталитическое количество FeCI3.
Сульфирование
Сульфирование бензола можно осуществить дымящей серной кислотой (Н2SО4+ SO3).

В этой реакции электрофильным реагентом является трёхокись серы SO3 - нейтральная молекула, в которой три электроотрицательных атома кислорода, связанные с атомом серы, делают последний электрононенасыщенным.
Стадия образования карбокатиона.

Стадия стабилизации карбокатиона. Карбокатион отдаёт протон с образованием аниона бензолсульфоновой кислоты.


Каждая стадия реакции сульфирования обратима, поэтому и весь процесс является обратимым. Применение серной кислоты, богатой олеумом, сдвигает равновесие в сторону образования бензолсульфоновой кислоты.
Причина обратимости реакции сульфирования в том, что энергетические барьеры по обе стороны от s-комплекса приблизительно одной высоты (рис. 7.5).
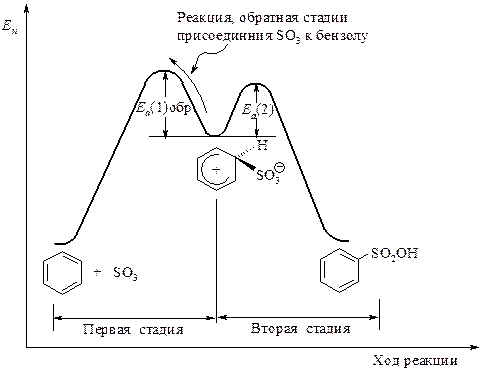
Рис. 7.5. Энергетическая диаграмма сульфирования бензола
Сравните энергетический барьер отрыва SO3 от s-комплекса Еа(1)обр. с энергетическим барьером отрыва протона от s-комплекса Еа(2).
Обратная реакция - превращение бензолсульфоновой кислоты в бензол - достигается обработкой её водяным паром, нагретым до температуры выше 100 оС.

|
из
5.00
|
Обсуждение в статье: Физические свойства аренов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

