 |
Главная |
Механизм комплексообразования
|
из
5.00
|
Существуют два основных подхода к теории образования комплексных соединений. С точки зрения электростатического подхода их образование происходит за счет кулоновского притяжения частиц и их взаимной поляризации. В основе другого подхода лежит допущение формирования так называемой донорно–акцепторной)связи. По этим представлениям атомы со свободными электронными парами стремятся использовать их для связи с другими частицами. Вместе с тем атомы с дефицитом электронов имеют тенденцию приобести их за счет чужих электронных пяр. Атомы первого типа носят название доноров, второго – акцепторов Если обе тенденции выражены достаточно сильно, то между атомами возникает связь при участии электронной пары донора. Вероятно, в многоступенчатом процессе конмплексообразования участвуют и кулоновы силы и донорно–акцепторная связь.
Начинается процесс комплексообразования с ориентационного взаимодействия диполей H2O с отдельными ионами, т.е. с гидратации. С ростом минерализации этот процесс сменяется образованием самых простых и наиболее прочных комплексных образований – ионных пар. При дальнейшем увеличении концентрации раствора образуются более сложные комплексные образования, включающие несколько лиганд, а иногда и несколько центральных атомов.
Гидратация и гидролиз
Очень высокая диэлектрическая проницаемостьрастворителя (81,0 ед. СГСЭ) препятствует взаимодействию растворенных компонентов между собой. Поэтому в разбавленных водных растворах, где компоненты достаточно удалены друг от друга, преобладающим процессом комплексообразования является их гидратация. Выше рассматривалось влияние гидратов на структуру водного раствора, но не сам процесс их образования. Этот обратимый процесс не меняет величину заряда ионов, но ззаметно влияет на ихактивность. Тем самым он участвует в поведении главных растворенных компонентов и играет важную роль в формировании состава подземных вод.
В зависимости от обстановки можно выделить два типа гидратации: гомогенный, как процесс образования гидратов в гомогенной среде, и гетерогенный, как процесс взаимодействия диполей H2O с поверхностью неводной среды.
Гидратация в гомогенной среде рассматривается как химический процесс межмолекулярного ориентационного взаимодействия растворенного вещества с диполями H2O. Её обратной реакцией является дегидратация (dehydration). Эти процессы идут поэтапно, т.е. с замещением по одному лиганду в порядке очереди, и могут сопровождаться изменением координационного числа.
Гидратация всегда направлен в сторону большей потери энергии. Если при гидратировании иона Co2+ свободная энтальпия уменьшается на -53,5 Дж/моль, а при комплексообразовании на -89,3 Дж/моль, то комплексообразованиеоказывается энергетически более выгодным, и лигандыбудут замещать диполи H2O, т.е. будет иметь место дегидратация.
В результате гидратации ионовобразуются гидраты, также называемые аквакомплексами. Максимальное количество диполей H2O в этих аквакомплексах определяется координационным числом, величина которого зависит, прежде всего, от заряда ионов. Для Ag+ и Be3+ оно равно 4, для двух- и трехвалентных переходных металлов - 6, а для больших переходных ионов лантаноидов и актиноидов достигает 9. Характер аквакомплексов определяется свойствами ионов и концентрацией H2O
Ряд катионов (Na+, K+, Fe2+ и т.д.) не влияет на состояние гидратированных диполей H2O и сохраняют их в аквакомплексе целиком. Их гидратация в гомогенной среде связана с реакцией простого замещения лиганд при опреснении раствора. Примером реакции полного замещения может быть:
[CoCl4]2- + 6H2O ↔[Co(H2O)6]2+ + 4Cl-
Обобщенное уравнение этой реакции имеет вид:
[MLn]z+ +pH2O ↔[M(H2O)p]z+ +nL
где p- координационное число аквакомплекса катиона M. Эта реакция гидратации находится в равновесии, когда
 (II‑187)
(II‑187)
где aaq – активность аквакомплекса (гидрата), Kaq– константа его устойчивости. Отсюда следует, что
 . (II‑188)
. (II‑188)
Гидратация таких катионов зависит только от активности H2O и усиливается с опреснением воды. По мере снижения минерализации воды активность лиганд L падает, а активность H2O стремится к 1, и доля гидратированных ионов растет.

| Рисунок II-22. Гидратация (a) катиона и (b) аниона. Когда ионы растворены в воде, они притягивают и удерживают диполи H2O вокруг себя в сферах, показанных на рисунке. |
Однако, для многих металлов (Fe3+, Zn4+, Al3+ и др.) гидратация сопряжена с гидролизом. Около переходных металлов поляризованность гидратированных диполей H2O увеличивается, всллледствие чего связь O-H в них ослабевает. Вследствие этого аквакомплекс приобретает способность терять и присоединять протон H+, т.е. приобретает свойства кислоты. Такая гидратация оказывается в зависимости от величины pH раствора. Действительно, процесс гидратации гидрокиси можно представить как последовательность обратимых реакций:
[M(H2O)3(OH)3]0 + H3O+↔[M(H2O)4(OH)3]+ + H2O
[M(H2O)4(OH)2]+ + H3O+↔[M(H2O)5(OH)]2+ + H2O
[M(H2O)5(OH)]2+ + H3O+ ↔ [M(H2O)6]3+ + H2O
Эти реакции похожи на реакции замещения гидроксильного иона диполем H2O, тогда как на самом деле происходит обмен только протонами H+. Общее уравнение полной гидратации тогда имеет вид:
[M(H2O)3(OH)3]0 + 3H3O+ ↔ [M(H2O)6]3+ + 3H2O
Равновесие этой реакции достигается при условии, что:

Для разбавленных растворов активность H2O близка к 1 и може быть исключена из равенства. Тогда уравнение в логарифмической форме имеет вид:
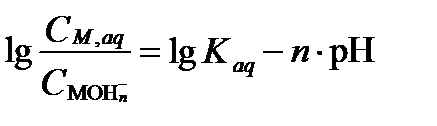
Из этого уравнения видно, что доля гидратированных катионов металлов увеличивается с уменьшением величины pH. Константа полной гидратации pKaq равна –1,26·10-4 для Cr3+,– 6,3·10-3 для Fe3+. В случае очень сильной поляризации связей H2O около высоко заряженных ионов металлов, например у Zr, полные аквакомплексы могут существовать только в очень кислых растворах, или не образуются совсем. Вместо этого наблюдаются комплексы с гидрокисью и/или оксолигандами, которые могут или не могут содержать H2O. Примером могут быть: Ti(OH)22+(H2O),VO2(H2O)4+, CrO3(OH)- и MnO4-. Большинство металлов с удалением лиганд стремятся образовать гидраты с 6 диполями H2O, которые придают раствору характерную окраску: [Fe(H2O)6]2+ бледно зеленую, [Cu(H2O)6]2+ голубую, [Co(H2O)6]2+ розовую, [Fe(H2O)6] 3+ рыжую, [Cr(H2O)6]3+ голубовато-зеленую, [Al(H2O)6]3+ бесцветную, [V(H2O)6]3+ зеленую.
Наконец, целый ряд анионов (Cr6+, S+6, C4+ и др.) при гидратации теряют оба H+ и образуют оксокомплексы (oxycomplex )типа CrO42-, MnO4-, SO42-, CO32- и т.д..
| | Рисунок II-23. Зависимость преобладающих форм существования элементов в водном растворе от величин их валентности и pH. |
Таким образом, при гидратации положительно заряженные катионы стремяться оттолкнуть протон в составе диполя H2O. Эти силы отталктваения тем больше, чем меньше радиус катиона и выше его заряд. Поэтому одни катионы (Na+, K+, Fe2+ и т.д.) с низким зарядом сохраняют диполи целиком, другие (Fe3+, Al3+ и др.) образуют гидроксокомплексы (hydrocomplex)типа Fe(H2O)4(OH)2+ , третьи (Cr6+, S+6, C4+ и др.) теряют водород полностью и образуют оксокомплексы типа CrO42-, MnO4-, SO42-, CO32- и т.д.). Вследствие этого формы существования таких катионов находятся в зависимости от величины pH, что видно на рисунке II-12.
Гидратацияна границе разных сред будет рассмотрена вместе с гетерогенными процессами ниже.
Ионные пары
Образование ионных пар (ion pairs)являются самой простой формой взаимодействия диссоциированных ионов и первым шагом к комплексообразованию. По мере роста минерализации расстояния между растворенными компонентами сокращяются, и они начинают чаще встречаться и взаимодействовать. Наиболее эффективно взаимодействуют противоположно заряженные ионы, которые под воздействием электростатических сил стремятся сблизиться.
| | Рисунок II-24. Процесс образования ионных пар и комплексов. Senso strict – в буквальном смысле |
Непосредственное образование ионных пар связано с взаимодействием положительно и отрицательно заряженных аквакомплексов. На первом этапе между ними могут сохраняться диполи H2O. Такие гидратированные ионные пары называют неконтактными (uncontact ). Их примером могут быть
{[Cu(H2O)6]2+Cl-}, {[Mn(H2O)6]2+ 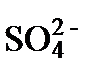 }, {[Al(H2O)6]3+
}, {[Al(H2O)6]3+  }.
}.
Постепенно с ростом минерализации, ионы вытесняют гидратированные диполи H2O, и ионные пары становятся контактными (contact). Этот процесс удаления гидратированных диполей H2O называют дегидратацией ионов.
Процесс образования ионных пар можно представить общим уравнением:
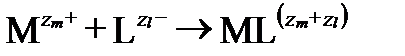 ,
,
где  - катион с зарядом +zm,
- катион с зарядом +zm,  - анион с зарядом -zl,
- анион с зарядом -zl,  – ионная пара с зарядом равным zm -zl.
– ионная пара с зарядом равным zm -zl.
Например:
Al3+ + CO32- ® [AlCO3]+.
В зависимости от величин зарядов их разность (zm -zl), может быть положительной, отрицательной или нейтральными:
Ag+ + 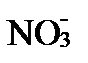 ®
®  .
.
Ионные пары могут иметь достаточно высокий дипольный момент, чтобы взаимодействовать с другими ионами. Поэтому по мере роста минерализации дегидратация ионов продолжается, и диполи H2O замещаются ионами. Согласно координационной теории, предложенной Альфредом Вернером (1866-1919) в 1893 г., одни ионы, обычно положительно заряженные катионы, занимают центральное место и называются комплексообразователями, а другие, обычно ионы, располагаются вокруг, и называются лигандами (ligand) или аддендами (addend). Эти более сложные надмолекулярные образования называют комплексными (complex compound)или координационными соединениями (coordination compound), а сам процесс их образования – комплексообразованием.
Межионная связь в комплексах характеризуется некоторым средним расстоянием сближения и может быть междипольной, ионодипольной, иногда водородной, но наиболее распространенной является донорно-акцепторная (donor-acceptor bonding). Анионы играют роль донора электронов, а катионы – акцепторов. Наибольшее число лиганд, т.е. координационное число, зависит как от их электронной структуры, так и от соотношения радиусов взаимодействующих ионов. По мере роста концентраций этих ионов увеличивается количество ассоциированных соединений. При этом один и тот же диссоциированный ион может оказаться в составе нескольких разных комплексных соединениях.
Процесс комплексообразования представляет собой сложную обратимую реакцию последовательного замещения диполей H2O анионами. Присоединение или потеря каждого лиганда рассматривается как отдельный акт (ступень). Присоединение леганда с образованием более сложного комплекса называют ассоциацией (association), а его потерю с образованием более простых соединений – диссоциацией (dissociation). Процесс начинается с образования ионной пары:
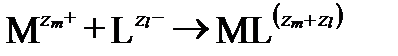 ,
,
и продолжается как поочередное замещение диполей H2O лигандами:
 ,
,
 ,
,
...
 ,
,
...
 ;
;
Если эти реакции просуммировать, получим одно обобщенное уравнение образования последнего, самого сложного комплекса:
 .
.
В этих уравнениях  - центральный комплексообразующий катион с зарядом +zm, L- леганд с зарядом –zl, Α- координационное число, а j – порядковый номер ступеней комплексообразования. Серия уравнений отдельных актов характеризует механизм реакции, а общее уравнение определяет конечный результат процесса.
- центральный комплексообразующий катион с зарядом +zm, L- леганд с зарядом –zl, Α- координационное число, а j – порядковый номер ступеней комплексообразования. Серия уравнений отдельных актов характеризует механизм реакции, а общее уравнение определяет конечный результат процесса.
Чем выше концентрация аниона, тем больше леганд он способен образовать в комплексных соединениях. Когда достигается максимально возможное для данного комплексообразователя координационное число, образование более сложных соединений прекращается, а содержание комплексов с меньшим числом лиганд постепенно уменьшается. В конечном итоге, один и тот же лиганд способен образовывать несколько разных соединений с одним и тем же центральным атомом, относительное содержание которых меняется, как функция его концентрации (Рис. II-14).

| Рисунок II-25. Распределение хлоридных комплексов Hg2+ в зависимости от молярной концентрации Cl-. |
По мере присоединения лиганд заряд комплексного образования уменьшается. Когда суммарный заряд лиганд становится равен заряду центрального катиона, комплексное соединение становится нейтральным. Такие соединения обладают самой низкой растворимостью и легко выпадают в осадок в виде солей аналогичного состава. Вместе с собой они удаляют и часть растворителя, образуя кристаллогидраты (соду - Na2CO3×10H2O, бишофит - MgCl2×6H2O и т.д.). Обычно кристаллогидраты образуются в насыщенных или перенасыщенных рассолах, и могут удалять до 10 диполей H2O. Например, Na2CO3может захватить с собой 1 или 10 H2O, а MgCl2 - 2, 4, 6 или даже 8. Величины стандартной свободной энтальпии этих нейтральных образований в растворе, как правило, на 12,6 - 52,6 кДж/моль (3-11 ккал/моль) меньше, чем у аналогичных солей вне раствора. Координационное число может превышать заряд центрального атома. Тогда комплекс становится отрицательно заряженным и ведет себя, как анион. Так ион алюминия Al3+ способен присоединять от 1 до 6 ионов фтора F-.
|
из
5.00
|
Обсуждение в статье: Механизм комплексообразования |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

