 |
Главная |
Закомплексованность ионов
|
из
5.00
|
В реальных природных водах один и тот же аналитически установленный компонент может входить в состав множества разных комплексных соединений, концентрации которых при равновесии связаны между собой законом действия масс.
Предположим, что в результате анализа в водном растворе установили присутствие диссоциированных катионов I и анионов J с общими мольными концентрациями [Mi] и [Lj], соответственно. Весьма вероятно, что до анализа в условиях равновесия часть этих катионов и анионов входила в состав разных комплексных образований. Допустим, что эти комплексные образования содержали не более Κ ядер катиона Mi и не более Α лиганд аниона Lj. Тогда суммарная концентрация катиона Miво всех допустимых формах их комплексных соединений, согласно таблице II-13, определяется уравнением:
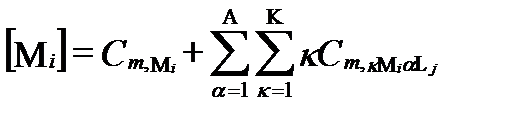 , (II‑197)
, (II‑197)
а суммарную концентрацию лиганда Lj в тех же формах комплексных соединений, согласно таблице II-14, можно выразить уравнением:
 , (II‑198)
, (II‑198)
где  и
и  - концентрации незакомплексованных ионов i и j. Здесь и далее для выражения концентраций вместо молярности используется моляльность. Реальный раствор содержит не один, а I катионов и не один, а J анионов. Поэтому суммарная концентрация катиона Mi в его комплексных соединениями со всеми анионами примет вид:
- концентрации незакомплексованных ионов i и j. Здесь и далее для выражения концентраций вместо молярности используется моляльность. Реальный раствор содержит не один, а I катионов и не один, а J анионов. Поэтому суммарная концентрация катиона Mi в его комплексных соединениями со всеми анионами примет вид:
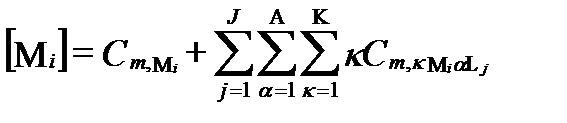 , (II‑199)
, (II‑199)
а суммарная концентрация аниона Lj в его комплексных соединениями со всеми катионами будет равна:
 (II‑200)
(II‑200)
Рисунок II-27. Концентрация катион Mi в комплексных соединениях только с одним анионом Lj .
| Число ядер | Концентрации катиона Mi в комплексах с разным числом лиганда Lj | Суммарные концентрации катиона Mi | |||
| α =1 | α =2 | … | α =Α | ||
| κ =1 | 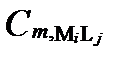
| 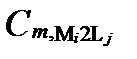
| … | 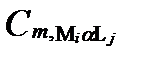
| 
|
| κ =2 | 
| 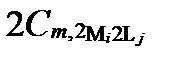
| … | 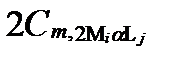
| 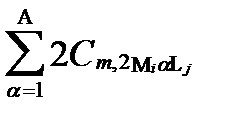
|
| … | … | … | … | … | … |
| κ =K | 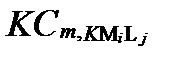
| 
| … | 
| 
|
| Всего | 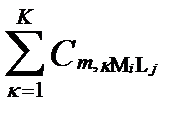
| 
| … | 
| 
|
Концентрацию любого комплексного соединения можно определить через равновесное содержание его незакомплексованных катионов и анионов, используя полную константу устойчивости. Чтобы упростить задачу, предположим, что ионы не образуют смешанные и гетерополиядерные комплексные соединения. Тогда реакцию их образования можно представить уравнением:
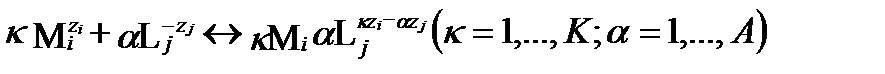 .
.
Согласно уравнению II-101 равновесную концентрацию любого комплексного образования можно определить по содержанию незакомплексованных катионов и анионов с помощью концентрационной константы:
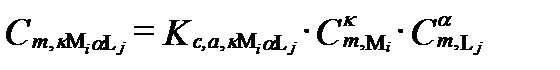 . (II‑201)
. (II‑201)
Здесь  и
и 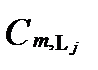 - концентрации незакомплексованных катионов и анионов, [Mi] и [Lj] – их аналитические концентрации, а Ka,c – концентрическая константа устойчивости. Если какое-либо из комплексных образований не существует, его константа устойчивости принимаетсяют равной нулю.
- концентрации незакомплексованных катионов и анионов, [Mi] и [Lj] – их аналитические концентрации, а Ka,c – концентрическая константа устойчивости. Если какое-либо из комплексных образований не существует, его константа устойчивости принимаетсяют равной нулю.
Рисунок II-28. Концентрации аниона Lj в комплексных соединениях только с одним катионом Mi.
| Число ядер | Концентрации аниона Lj в комплексах с разным числом катиона Mi | Суммарные концентрации аниона Lj | |||
| α =1 | α =2 | … | α=Α | ||
| κ =1 | 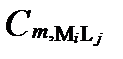
| 
| … | 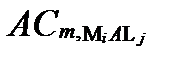
| 
|
| κ =2 | 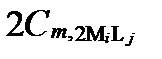
| 
| … | 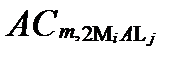
| 
|
| … | … | … | … | … | … |
| κ =K | 
| 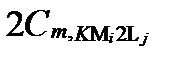
| … | 
| 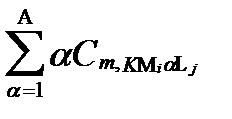
|
| Всего | 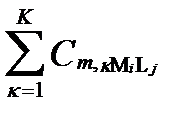
| 
| … | 
| 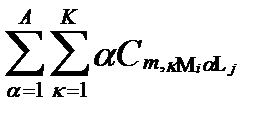
|
Заменим непосредственное выражение концентраций комплексных образований в уравнениях II-158 и II-159 их выражением в уравнении II-160, т.е. концентрациями их диссоциированных катионов и анионов:
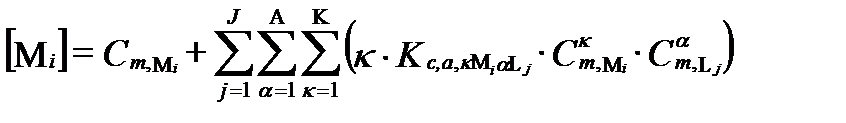 (II‑202)
(II‑202)
и
 . (II‑203)
. (II‑203)
Эти уравнения связывают между собой величины концентраций незакомплексованных (диссоциировнных) ионов  и
и  . По их концентрациям можно определить концентрации всех закомплексованных соединений.
. По их концентрациям можно определить концентрации всех закомплексованных соединений.
Если общие молярные концентрации [Mi] и [Lj] разделить на соответствующие им концентрации незакомплексованных ионов  и
и  , то получим коэффициенты закомплексованности в условиях равновесия, которые в случае комплексообразования чаще называют функцией закомплексованнности. Функции закомплексованности катионов и анионов равны:
, то получим коэффициенты закомплексованности в условиях равновесия, которые в случае комплексообразования чаще называют функцией закомплексованнности. Функции закомплексованности катионов и анионов равны:
 . (II‑204)
. (II‑204)
 . II‑205)
. II‑205)
Если катион образует только одноядерные комплексные соединения, то его функция закомплексованности будет заметно проще:
 . (II‑206)
. (II‑206)
При  = 1, комплексные соединения катиона Mi отсутствуют, при очень высоких значениях функции
= 1, комплексные соединения катиона Mi отсутствуют, при очень высоких значениях функции 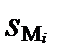 все ионы Mi фактически закомплексованы. Функция закомплексованности играет важную роль в термодинамических расчетах равновесного взаимодействия растворенных компонентов.
все ионы Mi фактически закомплексованы. Функция закомплексованности играет важную роль в термодинамических расчетах равновесного взаимодействия растворенных компонентов.
Во-первых, она позволяет определять содержание незакомплексованного диссоциированого иона по его аналитическому содержанию в равновесном растворе:
 и
и  . (II‑207)
. (II‑207)
где концентрации [Mi] и [Lj] характеризуют аналитическое содержание соответствующих ионов.
Во-вторых, функция закомплексованности позволяет перейти от термодинамических или концентрационных констант равновесия к условным, что удобно при расчетах равновесных концентраций.
В-третьих, часто достаточно знать только относительное распределение иона в его комплексных соединениях. Допустим, надо определить, как распределен катион Mi в разных комплексных образованиях с лигандом Lj относительно суммарного содержания катиона. Такое содержание иона i в составе одного комплексного соединения относительно его суммарного, аналитического содержания в растворе называют функцией распределения (distribution function). Для незакомплексованного (диссоциированного) катиона Mi эта функция  . Для любого катиона с лигадом Lj функция распределения выражается уравнением:
. Для любого катиона с лигадом Lj функция распределения выражается уравнением:
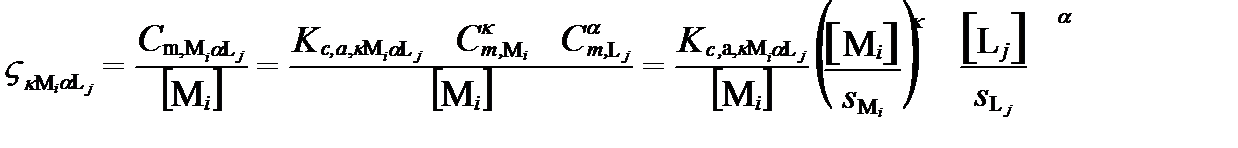 , (II‑208)
, (II‑208)
а для любого аниона с центральным атомом Mi – уравнением:
 . (II‑209)
. (II‑209)
Сумма всех функций распределения одного катиона или аниона должна быть равна 1, имеем равенства:
 , (II‑210)
, (II‑210)
 . (II‑211)
. (II‑211)
Как видно из приведенных уравнений все комплексные образования отдельного катиона или аниона связаны между собой. Для определения их относительных концентраций по аналитическим достаточно определить функцию закомплексованности. Из уравнений II-167 и II-168 видно, чем выше величина константы устойчивости соединения, т.е. чем оно прочнее, тем выше его относительное содержание. В то же время, чем больше величина функции закомплексованности, тем большее число комплексных соединений присутствует в растворе, но тем меньше их относительные концентрации.
Величины закомплексованности зависят от кислотно-щелочных и окислительно-восстановительных свойств воды.
Концентрации протона особенно заметно влияют на закомплексованность протонированных лиганд многосновных кислот. Эти кислоты способны образовывать лиганды с разным количеством H+. Например, фосфорная кислота может иметь в растворе H3PO4, H2PO4-, HPO42- и PO43-.
Балансовое уравнение этой кислоты при общей аналитической концентрации [Lj] будет иметь вид
 . (II‑212)
. (II‑212)
Обобщенная реакция протонирования многоосновной кислоты имеет вид:
Lj + κH+ → HκLj .
Тогда концентрации кислот разной основности равны:
 ; (II‑213)
; (II‑213)
А балансовое уравнение II-206 примит вид:
 . (II‑214)
. (II‑214)
Тогда функции закомплексованности и распределения многоосновной кислоты будут соотвественно:
 ; (II‑215)
; (II‑215)
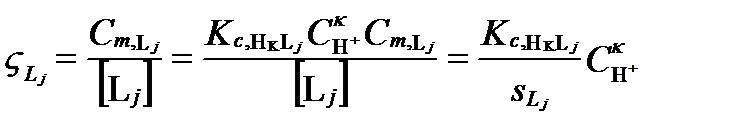 . (II‑216)
. (II‑216)
Логарифмируя последнее уравнение получим:
 (II‑217)
(II‑217)
Так как концентрации H+ всегда значительно меньше 1, с понижением pH закомплесованность многоосновных кислот растет.
Окислительно-восстановительный потенциал влияет на закомплксованность тех компонентов, которые способны менять валентность. Атомы разной степени окисленности обрадают заметно разными химическими свойствами и участвуют в комплексообразовании независимо друг от друга. Величина Eh влияет на относительное содержание этих атомов и тем самым на состав комплексных соединений в воде.
Двойной электрический слой
Адсорбция
Массообмен между минералом и подземной водой происходит, как правило, в тонком слое физически связанной воды, в условиях конкуренции сил теплового (броуновского) движения, электростатического и межатомного взаимодействий. Физически свяхзанной считается вода между поверхностью минерала и плоскостью скольжения. Эта вода неподвижна или малоподвижна, и её состав определяют силы, действующие только в её границах. Ближе к плоскости скольжения ведущую роль играет тепловое движение, которое стремится сохранить состав воды нейтральным и однородным. С приближением к поверхности раздела усиливается электростатическое влияние, которое способствует дифференциации ионов по знаку и величине их зарядов. Это влияние растет по мере приближения к минералу и проявляется в привлечении противоположно заряженных и отталкивании одинаково заряженных ионов. В итоге концентрации противоположно заряженных компонентов к поверхности увеличиваются. Такое концентрирование отдельных растворенных компонентов у поверхности раздела называют адсорбцией. Наконец, у самой поверхности минерала растворенные компоненты способны вступать в физическую или даже химическую связь с минералом, образуя поверхностные комплексы. Релаксация взаимоотношений минерала и подземной воды способствует формированию сложной, но стабильной структуры равновесного распределения диполей H2O и ионов раствора в этом слое, иногда называемом слоем Нернста. Существуют разные представления о структуре этого слоя.
Первую модель его структуры предложил Г. Л. Гельмогльц (1821-1894) ещё в 1853 году. Его модель представляла собой простой плоский конденсатор, у которого одой пластиной служила поверхность электрода, т.е. минерала, а другой – неподвижные ионы раствора, прочно привязанные к его поверхности. Плоскость, которая отделяла прочно связанные ионы от свободно мигрирующих в воде, называли впоследствии плоскостью Гельмгольца (Helmholtz plane), а саму модель – модельюдвойного электрического слоя (model of double electric layer).
В 1910-1913 г. Луи Георг Гуи (1854 – 1926) и Давид Леонард Чапман (1869-1958) независимо друг от друга пришли к выводу, что заряду поверхности электрода (минерала) противостоят ионы, не прочно связанные, а подвижные у поверхности. Они полагали, что поверхностному заряду противостоит слой воды с диффузно подвижными ионами и противоположным зарядом. Эта модель, которая практически не учитывала влияние компонентов, прочно связанных с поверхностью раздела, получила название модели двойного диффузного слоя (model of double diffuse layer).
Отто Штерн (1888-1969) в 1924 г предложил вернуть тонкий слой прочно связанных молекул между поверхностью раздела и диффузным слоем. Его поэтому часто называют слоем Штерна (Stern layer). В итоге модель системы приобрела вид двух последовательно соединенных конденсаторов. В первых моделях практически не учитывались характер и состав компонентов прочно связанных с поверхностью минерала и их влияние на заряд диффузного слоя.
В 1947 году Дональд Грэм предположил различать две плоскости Гельмгольца: внутреннюю, проходящую по центрам адсорбированных молекул растворителя и ионов без гидратной оболочки, и внешнюю, проходящая по центрам адсорбированных, но гидратированных ионов. Таким образом, он допускал присутствие между поверхностью раздела и раствором трех последовательно соединенных конденсаторов.
Наконец, в 1963 Джон О’Мара Бокрис (1923) вместе с М. Деванатаном и К. Мюллером предложили модель, которая учитывает преобладающую роль растворителя в формировании заряда поверхности раздела. Они учли влияние диполей H2O и так называемых специфических ионов на заряд диффузного слоя. Эта модель считается лучшей для исследования процессов, которые имеют место на контакте подземной воды с породой. Так последовательно формировалось представление о двойном электрическом слое (double electrical layer), как о слое растворов электролитов у контакта с твердыми веществами со специфическим поведением полярных компонентов.
|
из
5.00
|
Обсуждение в статье: Закомплексованность ионов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

