 |
Главная |
Определение окислительного потенциала раствора
|
из
5.00
|
В природных водах происходит не одна, а несколько окислительно-восстановительных реакций. Эти реакции связаны с присутсвием элеменов, которые способны менять свой заряд в зависимости от электрического потенциала раствора. Поэтому окислительно-восстановительный потенциал раствора в целом определятся характером и концентрацией этих элементов. Те компоненты, которые заметно влияют на окислительно-восстановительный потенциалраствора, называют электроактивными. Элементы, концентрация и форма существования которых фактически контролирует окислительно-восстановительный потенциал раствора, называют потенциал задающими. В природных водах таковыми могут быть O, S, C, N и Fe. Растворы, которые содержат достаточно высокие концентрации таких компонентов и поэтому почти не меняют величину окислительно-восстановительного потенциала при добавлении окислителей или восстановителей, называют редокс-буферами.
Окислительно-восстановительный потенциал раствора в целом может быть определен тремя способами:
1- по концентрациям компонентов отдельной редокс-пары,
2- непосредственно с помощью стандартного водородного электрода и
3- по относительному содержанию электроактивных компонентов в растворе.
1. В первом случае окислительно-восстановительный потенциал определяется по относительным концентрациям компонентов одной родекс-пары. Обычно такие пары выбирают среди переходных металлов, чаще всего Fe3+ и Fe2+. Эти металлы не всегда являются потенциал задающими, но они относительно быстро достигают равновесных концентраций, определяемых величиной Eh раствора. Этот метод оценки величины Eh показан на примере II-6.
Пример II‑6.
В пресной воде обнаружили 10-3,3 моль/л Fe2+, и 10-5,9 моль/л Fe3+. Надо определить величину Eh раствора.
Предположим, что концентрации этих ионов железа уравновешены. Они взаимодействуют согласно полуреакции: Fe3+ + e– = Fe2+. Стандартный электродный потенциал этой реакции 10, lg KFe = -13, ze=1. В пресной воде коэфициенты активности можно приравнять к 1.
Возможны два решения.
Способ 1: При равновесии справедливо уравнение:
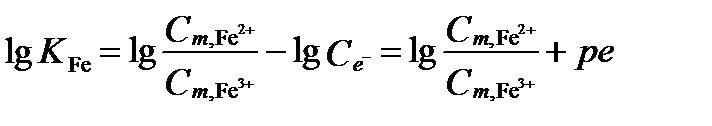 .
.
Тогда  , Eh=0,059∙10,4=0,61 В.
, Eh=0,059∙10,4=0,61 В.
Способ 2: Согласно уравнению Нернста
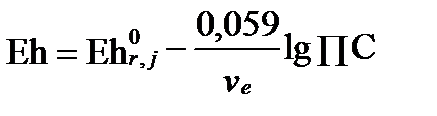 = 0,771- 0,059 lg (10-3,3∙10+5,9) = 0,77- 0,15 = 0,62 В
= 0,771- 0,059 lg (10-3,3∙10+5,9) = 0,77- 0,15 = 0,62 В
Следовательно вода имеет окислительно-восстановительный потенциал +0,62 В, что на 0,15 В ниже, чем требуется для равновесия. Такой раствор испытывает дефицит электронов и является окислителем.
Однако окислительно-восстановительные реакции в растворе идут с разной скоростью, величина которой часто зависит от содержания и характера микроорганизмов. Наиболее быстрыми считаются лишь окислительно-восстановительные реакции между металлами (например, Fe2+↔Fe3+, Sn2+↔Sn4+ и т.д.), периоды полураспада которых измеряются минутами или часами. Редокс-реакции с анионами, особенно с органическим веществом при участии O2 и гидролиза, идут значительно медленнее. Это вызвано тем, что эти реакции имеют высокие энергии активации, связаные с разрушением прочных ковалентных связей. Многие из таких окислительно-восстановительных процессов в природных условиях реализуются только за счет биохимического катализа (например, N2 →NO2-→ NO3-). Скорости таких процессов очень низкие и нестабильные: микробные популяции должны приспособиться к среде и вступить в непосредственный контакт с редокс парами. Лишь окисление сульфидной серы в щелочной среде можно отнести к достаточно быстрым процессам. Многие окислительно-восстановительные реакции слишком медленны из-за чрезвычайно больших констант равновесия, и по существу необратимы. Период полураспада таких реакций может достигать нескольких лет. По этой величину Eh отдельных редокс-пар редко когда может быть критерием окислительно-восстановительного потенциала раствора в целом.
Однако, этот метод используют для определения потенциала редокс-буфера, который, как правило, выражают величиной равновесной фугитивности кислорода. В этом случае кислород используется в качестве донора электронов в окислительно-восстановительных реакциях. Тогда реакция окисления железа имеет вид:
Fe2++ 0,25O2+ H+= Fe3++ 0,5H2O
а окисления серы:
H2S+ 2 O2(газ)= SO42-+2H+.
Здесь активность кислорода используется как показатель или индекс редокс-условий, независимо от того, есть ли кислород в системе или его нет. В условиях равновесия последняя реакция имеет активности, связанные величиной константы равновесия:
 .
.
Окислительно-восстановительный потенциал этой равновесной обстановки можно выразить величиной фугитивности кислорода, которая при Kr=10126 и pH=7 равна:

Обычно потенциал редоекс-буфера определяют по соотношению минеарльных форм элементов разной степени окисления. В осадочных породах в качестве его показателя используются реакция превращения магнетита в гематит:
4 Fe3O4 + O2 = 6 Fe2O3.
Окислительная обстановка условий осадкообразования и диагенеза обычно харакьеризуется фугитивностью кислорода от 0,2 атм на поверхности до 10-70 атм в стандартных условиях.
2. Определение величины Eh раствора с помощью стандартного водородного электрода представляется более достоверным. В этом случае окислительно-восстановительный потенциал определяют непосредственно в воде, сравнивая его с потенциалом стандартного водородного электрода, величина которого принята равной 0. Устройство этого электрода представлено на рис. II-8

| Рисунок II-17. Принцип сопоставления Eh раствора с потенциалом стандартного водородного электрода. А- испытуемая вода, B – стандартный водородный электрод. |
Величины Eh, измеренная таким способом, характеризуют отклонение некоторого усредненного, не обязательно уравновешенного, потенциала ∆Eраств. раствора в целом от потенциала стандартного водородного электрода:
Eh=∆Eраств. - E0H. (II‑169)
При этом необходимо иметь в виду, что в реальных условиях потенциал водородного электрода не равен 0. Его потенциал определяется уравнением:
 . (II‑170)
. (II‑170)
Если E0H = 0,0 В, а  =1 атм, то:
=1 атм, то:
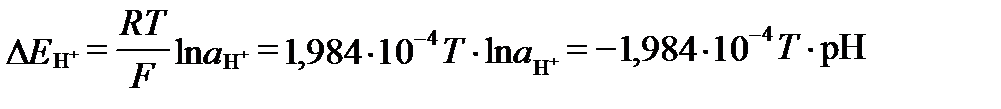 . (II‑171)
. (II‑171)
Коэффициенты активности обычных кислот достаточно хорошо изучены. Поэтому при температуре 25oC и  =1 атм:
=1 атм:
 . (II‑172)
. (II‑172)
Это уравнение характеризует поправку, которая обычно учитывается автоматически и минимизирует ошибки определениия Eh раствора вследствие нестабильности pH водородного электрода.
Кроме того, при измерении Eh элетродом необходимо учитывать влияние взаимодействия электрода с опробуемой водой, а именно его коррозию или адсорбцию дисперсного вещества на его поверхности. Например, при погружении в безкислородную воду богатую Fe2+ электрода с адсорбированным O2 на его поверхности может осаждаться FeOOH, что заметно влияет на его электроактивность. Измерения Eh электродным методом наиболее достоверны при исследовании кислых вод с высокими концентрациями Fe2+ и Fe3+.
Величины Eh, замеренные с использованием стандартного электрода, содержат в себе некоторую неопределенность. Очевидно, что растворы с большей величиной Eh играют роль окислителя по отношению к растворам с меньшей величиной Eh. Но это не означает, что все редокс-реакции раствора находятся в равновесии, и имеют одинаковую величину окислительно-восстановительного потенциала.
По этой причине величины Eh (pe), рассчитанные по разным родекс-парам одного и того же раствора и электродным методом дают широкий разброс значений. В большинстве случаев результаты, полученные электродным методом, плохо сопоставимы с резултатами, полученными по родекс-парам. Это видно на рисунке II-9, где величины Eh, замеренные в поле электродным методом, сопоставляются с величинами Eh, рассчитанными по родекс-парам.
Основная причина этого разброса заключается в отсутствии в природных водах полного равновесия окислительно-восстановительных реакций. Поэтому величины Eh электродного метода, как правило, не могут быть отнесены к какой-либо конкретной редокс-паре и использованы для интерпретации взаимодействия её компонентов. Исключением может быть случай, когда используемый электрод чувствителен только к одной родекс-паре. И наоборот, величина Eh, рассчитанная по концентрациям отдельной редокс-пары, не может быть использована для характеристики окислительно-восстановительного потенциала раствора в целом.

| Рисунок II-18. Сопоставление полевых электродных замеров Eh в подземных водах с потенциалами рассчитанными по отдельным родекс-парам (Lindberg, R.D., Runnells, D.D., 1984). |
3. Наконец, окислительно-восстановительный потенциал раствора можно расчитать, если известны все редокс-пары его состава и допускается их полное химическое равновесие.
Действительно, если имеется J родекс-реакций, которые идут одновременно и требуют по ve,j электронов на каждый акт обмена, то общее количество электронов, задействованных в окислительно-восстановительных процессах раствора, равно  . Тогда максимальная полезная работа всех гальваничесих микроэлементов раствора, согласно уравнению II-149, равна:
. Тогда максимальная полезная работа всех гальваничесих микроэлементов раствора, согласно уравнению II-149, равна:
 . (II‑173)
. (II‑173)
В тоже время минимальная свободная энтальпия всех этих реакций, согласно уравнению II-91, равна:
 (II‑174)
(II‑174)
где  и
и  - величины стандартных молярных потенциалов свободной энтальпии продуктов и реагентов всех редокс-реакций,
- величины стандартных молярных потенциалов свободной энтальпии продуктов и реагентов всех редокс-реакций,  - минимальные свободные энтальпии этих реакций при равновесии, ve,j – число электронов участвующих в этих реакциях. Сравнивая два последних уравнения, получим:
- минимальные свободные энтальпии этих реакций при равновесии, ve,j – число электронов участвующих в этих реакциях. Сравнивая два последних уравнения, получим:
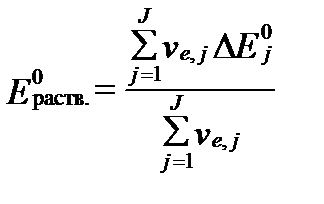 . (II‑175)
. (II‑175)
Например:
CO2+2H+ + 2e=CO+H2O (  = - 0,104 В)
= - 0,104 В)
CO+2H+ + 2e=C+H2O (  = 0,518 В)
= 0,518 В)
CO2+4H+ + 4e=C+2H2O (  = (2×0,518-2×0,104)/4=0,207 В)
= (2×0,518-2×0,104)/4=0,207 В)
Величина  характеризует общий окислительно-восстановительный потенциал раствора в условиях его полного химического равновесия. Однако, это равновесие в природных водах, как правило, отсутствует вследствие большой разницы в скоростях редокс-реакций. В связи с этим для оценки реального значения Ehраств. раствора необходимо учитывать реальные активности (концентрации) компонентов, участвующих в редокс-реакциях ратвора. Тогда согласно уравнениям II-150 и II-153 Eh раствора в целом равно:
характеризует общий окислительно-восстановительный потенциал раствора в условиях его полного химического равновесия. Однако, это равновесие в природных водах, как правило, отсутствует вследствие большой разницы в скоростях редокс-реакций. В связи с этим для оценки реального значения Ehраств. раствора необходимо учитывать реальные активности (концентрации) компонентов, участвующих в редокс-реакциях ратвора. Тогда согласно уравнениям II-150 и II-153 Eh раствора в целом равно:
 , (II‑176)
, (II‑176)
 . (II‑177)
. (II‑177)
Трудность использования этого уравнения связана с тем, что содержание элементов, участвующих в редокс-реакциях, обычно определяется без учета степени их окисления. Величина  раствора позволяет определять содержания элементов разной степени окисления, если известно их суммарное содержание, но только в условиях полного равновесия.
раствора позволяет определять содержания элементов разной степени окисления, если известно их суммарное содержание, но только в условиях полного равновесия.
Комплексообразование
Комплексообразование
Величины Eh (pe) определяет электрический потенциал и степень окисления отдельных поливалентных элементов, величина pH - относительное содержание ионов H+ и OH- в растворе. И то и другое характеризует условия, в которых растворенные компоненты взаимодействуют между собой. Главной и наиболее распространенной формой такого взаимодействия является комплексообразование. Комплексообразованиепредставляет собой сложный многоступенчатый процесс ассоциации отдельных компонентов в более крупные молекулярные образования. В этом процессе участвуют преимущественно ионы и диполи H2O, значительно реже нейтральные молекулы. Интенсивность этого процесса и многообразие образуемых комплексных соединений зависит от относительных концентраций задействованных компонентов.
|
из
5.00
|
Обсуждение в статье: Определение окислительного потенциала раствора |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

