 |
Главная |
Устойчивость комплексных образований
|
из
5.00
|
Комплексообразование идет, пока раствор не достигнит состава с минимальной величиной свободной энтальпии, т.е. равновесия. Направленность её элементарных реакций зависит от величины произведения активностей (или концентраций) участвующих в ней компонентов. При релаксации величины этих произведений стремятся к значениям констант равновесия. Когда комплексные соединения образуются, эти константы называют константами устойчивости (stability constant)(ассоциации) Ka, а когда разрушаются, диссоциациируют - константами неустойчивости (диссоциации)(instability constant)Kd. Такие константы для каждой отдельной ступени j находятся в обратной зависимости друг от друга и соответсвуют произведению равновесных активностей:
 . (II‑189)
. (II‑189)
 . (II‑190)
. (II‑190)
Константы отдельных элементарных реакций комплексообразования называют ступенчатыми константами (stepwise stability constant). Число таких констант равно числу ступеней. Суммарное равновесие всех ступеней образования любого одноядерного комплексного соединения определяется равенством:
 , (II‑191)
, (II‑191)
где Ka,Α – термодинамическая константа устойчивости (ассоциации) комплекса с числом лиганд Α. Константу всей сложной реакции комплексообразования называют полной константой устойчивости (over-all stability constant, cumulative или gross constant).Величину обратнную ей:
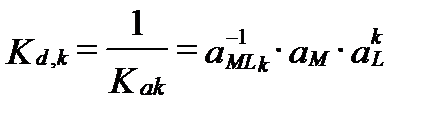 , (II‑192)
, (II‑192)
называют полной константой неустойчивости (over-all instability constant).
Например, если
Al3+ + 4OH- =  ,
,
то

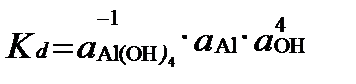
Ступенчатые константы устойчивости характеризуют образование комплексного соединения за счет присоединения только одного лиганда. Поэтому индекс j определяет и порядковый номер конечного продукта, и числу лиганд в нём. Полные константы устойчивости характеризуют образование любого комплексного соединения только из диссоциированных ионов независимо от числа лиганд в нём. Часто, чтобы отличить полные константы от ступенчатых, их обозначают символом βΑ. Полные и ступенчатые константы связаны между собой уравнениями:
 , (II‑193)
, (II‑193)
или
lgKa,Α =ålgKa,j. (II‑194)
Поэтому полные константы устойчивости иногда называют произведением устойчивости (stability product).
Как и в других случаях, рассматриваемые константы могут быть как термодинамическими(для активностей), так и концентрационными(для концентраций), которые связаны между собой уравнением:
 . (II‑195)
. (II‑195)
В очень разбавленных растворах разница между ними практически отсутствует, но увеличивается по мере роста минерализации.
Стандартная свободная энтальпия образования 1 моля любого комплексного образования связана с величиной константы устойчивости уравнением:
RT×lnKa,Α= -  . (II‑196)
. (II‑196)
Поэтому, чем больше константа устойчивости, тем прочнее образование, тем большую полезную работу необходимо совершить, чтоб его разрушить.
Устойчивость комплексов определяется, прежде всего, природой их центрального атома и лигандов. Большей устойчивостью обладают комплексы катионов с малым ионным радиусом и высокой степенью окисления, с неполяризующимися лигандами типа F-, ОН-. Достаточно устойчивые комплексные соединения образуют переходные металлы. Результаты многочисленных исследований показали, что устойчивость комплексных соединений увеличивается согласно «естественному порядоку устойчивости»: Mn2+, Fe2+, Co2+, Ni2+, Cu2+, независимо от природы лиганда и координационного числа. Меньшую устойчивость имеют катионы с большим ионным радиусом и низкой степенью окисления, которые более эффективно взаимодействуют с легко поляризующимися лигандами, содержащими S, P. Повышенной устойчивостью обладают хелатные комплексы. Чем выше прочность связей между комплексообразователем и лигандами, тем меньше заметны их индивидуальные свойства, и сильнее проявляются свойства их комплекса в целом. Многие металлы образуют очень прочные соединения с OH-, что приводит к их удалению из раствора, особенно при высоких значениях pH. Присутствие кислот препятствует этому. В частности, органические кислоты часто препятствуют удалению переходных металлов из раствора.
Как правило, увеличение числа лиганд сопровождается уменьшением устойчивости комплексного соединения. Это связано, прежде всего, с уменьшением пространства вокруг комплексообразователя и с электростатическим отталкиванием лиганд друг от друга. Например, величины ступенчатой константы устойчивости соединений алюминия и фтора с увеличением числа лиганд от 1 до 6 уменьшаются более, чем в миллион раз. Поэтому наиболее устойчивы комплексныесоединения первых ступеней образования, с минимальным числом лиганд, в частности ионные пары. Последние представляют собой самые маленькие, но наиболее прочные надмолекулярные соединения. При этом, чем выше величина их константы устойчивости, тем легче и в большем количестве они образуются. Как видно из таблицы II-12, самые прочные ионные пары образуют слабые кислоты и слабые основания, прежде всего, CO32- и Ca2+. Но наибольшей устойчивостью среди них обладает H2O. Наименее прочные соединения, которые в природных водах практически отсутствуют, образуют и сильные кислоты и основания.
Рисунок II-26. Величины констант устойчивости ионных пар в природных водах.
| Катионы | pKa | ||||
| Cl- | SO42- | HCO3- | CO32- | OH- | |
| K+ | -1,75 | 0,96 | 1,2 | -0,51 | |
| Na+ | -0,75 | 0,92 | -0,26 | 1,32 | -0,77 |
| Mg2+ | 0,66 | 2,23 | 0,88 | 2,98 | 2,32 |
| Ca2+ | -0,30 | 2,1 | 1,05 | 3,32 | 1,15 |
| H+ | -7 | 1,9 | 10,33 |
Комплексы с большим числом лиганд не прочны и для их существования необходимы повышенные активности (концентрации) образующих их анионов. Поэтому они встречаются в заметных количествах только в минерализованных водах.
Зависимость прочности комплексных соединений от температуры не однозначна. В частности прочность некоторых фторидных, хлоридных и даже карбонатных комплексов с ростом температуры увеличивается. При этом такие катионы как Li, Na и K, приобретают способность к комплексообразованию. Поэтому в термальных рассолах растет вероятность образования таких соединений, как NaCl0, KCl0, NaSO4-, KSO4- и др. Напротив, устойчивость прочных комплексов с увеличением температуры может заметно уеньшиться.
Влияние давления на устойчивость комплексных соединений несущественно и неоднозначно.
Сложные комплексные соединения в зависимости от их скорости взаимодействий делят на лабильные (labile), т.е. кинетически быстрые, и инертные (inert), заметно более медленные. К лабильным относят те, которые полностью обмениваются лигандами и достигают равновесия в течение 1 минуты при комнатной температуре и концентрации раствора 0,1 М. У инертных реакции замещения лигандов протекают значительно медленнее, более 2 минут, и может достигать равновесия в течение нескольких суток.
|
из
5.00
|
Обсуждение в статье: Устойчивость комплексных образований |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

