 |
Главная |
Слой Гильмгольца и поверхностный заряд
|
из
5.00
|
Согласно современным представлениям, до погружения в воду минералы имеют на своих гранях поверхностный заряд, связанный с наличием разорванных и некомпенсированных связей кристаллической решетки. Эти заряды образуют частично диссоциированные металлы (≡Al, ≡Fe и др.) или ионогенные групп (прежде всего ≡Si, ≡O, и др.), которые часто называют активными центрами (active centers).
При погружении в воду грани минералов подвергаются гетерогенной гидратации, т.е. покрываются тонким слоем ориентированных диполей H2O. Под влиянием активированных центров часть молекул H2O диссоциирует и принимают участие в гидролизе поверхности минерала, согласно реакциям:
≡M+ + H2O « ≡M‒OH + H+,
≡O- + H2O «≡OH + OH-.
где ≡M+ – метал, ≡O- - кислород на поверхности минерала.
Тем самым поверхность минерала приобретает по отношению к раствору свойства амфотерного вещества (Рис. II-16), которое может вести себя как основание, т.е. акцептор протона:
≡X‒OH + H+«≡X‒OH2+
или как кислота, т.е. донор протона:
≡X‒OH « ≡X‒O- + H+.
В итоге, большая часть активных центров поверхности минералов в воде действует не прямо, а через ионы H+ или OH-, относительное содержание которых зависит от величины pH раствора. Поэтом слой адсорбированных гидроксильных групп обычно рассматривают, как часть поверхности минерала.
| | Рисунок II-32. Виды взаимодействия активных центров минералов с диполем H2O: (a)-металл замещает поверхностный протон, (b)- лиганд замещает поверхностную группу OH (c) адсорбированный металл может связать дополнительный лиганд, (d) –лиганд связал дополнительный металл. Многодентатная адсорбция включает более чем одно место на поверхности. (White W.M., 1997) |
По характеру поведения ионов в непосредственной близости к гидратированной и протонированной поверхности минерала выделяют слой Гельмгольца (Helmholtz layer), который делят на две части: внутреннюю и внешнюю (Рис. II-17).
Внутренний слой Гельмгольца включает так называемые внутрисферные поверхностные комплексы (inner-sphere surface comlexes), т.е. комплексы связанные с поверхностью минерала непосредственно, а не через ионы H2O. Как правило, это металлы, замещающие H+, или лиганды, замещающие OH- (Рис. II-16). При этом адсорбированные металы способны связать дополнительный лиганд, а адсорбированный лиганд - дополнительный метал. Особую роль в этом слое играют внутрисферные комплексы, которые образуют анионы, обладающие наибольшим сродством с минералом. Они гасят значительную часть электростатического потенциала поверхности минерала и способны достраивать его кристаллическую решетку или образовывать у поверхности менее растворимые минералы. Эти особые комплексы, которые играют важную роль в процессах растворения и минералообразования, часто называют специфически адсорбированными (specifically-adsorbed comlexes).
| | Рисунок II-33. Схематическое изображение содержащей воду поверхности окисла, показывающее плоскости связанные с поверхностной гидроксильной группой (s), внутрисферные комплексы (a), внешнесферные комплексы (β) и рой диффузных ионов (d). В случае внутрисферного комплекса с лигандом (например, F- или HPO42-), поверхностные гидроксильные группы замещаются лигандами (лигандный обмен) (Stumm W., Morgan J.J., 1981) |
Внешний слой Гельмгольца включает так называемые внешнесферные поверхностные комплексы (outer-sphere surface comlexes), которые не имеют непосредственной связи с поверхностью минералов. Они сохраняют вокруг себя диполи H2O, и их взаимодействие с поверхностью минерала, аналогична взаимодействию ионов в неконтактных ионных парах. Внешнесферные комплексы также практически неподвижны.

|
| Рисунок II-34. Современная модель двойного слоя |
Слои Гельмгольца в целом частично компенсируют заряд активных центров поверхности, но не полностью. В итоге на его внешней границе формируется, так называемый, поверхностный электрический заряд (surface electric charge), который активно влияет на состав прилегающего к нему слоя воды.
Поверхностный заряд минерала изначально определяется числом и знаком зарядов его активированных центров σ0, связанных с дефектами или замещениями (например, Al на Si) в самой кристаллической решетке минералов, на единице поверхности. Одна часть этого заряда компенсируется зарядом σi комплексных образований на поверхности минералов. Особенно велика в этом роль специфического комплексообразования во внутреннем слое Гельмгольца. Другая большая часть σH гасится гидроксильной группой ≡X-OH, которая способна легко присоединять или терять H+. Поэтому плотность суммарного поверхностного заряда, а именно σпов, оказывается в зависимости от pH раствора. В итоге поверхностный заряд минерала в растворе определяется суммой:
σпов. = σ0 + σH+ σi (II‑230)
Если отнести количество компонента i прочно привязанного к единице площади поверхности минерала, то получим плотность его распределения:
 (II‑231)
(II‑231)
где CM,i – молярная концентрация адсорбированного иона i, моль·г-1, Sуд.в. – удельная поверхность минерала, м2·г-1. Эту плотность, измеряемую в моль·м-2, называют гиббсовской поверхностной концентрацией (Gibbs surface concentration)или поверхностной избыточной концентрацией (surface excess concentration). Тогда
σH = Φ(ГH - ГOH) (II‑232)
 (II‑233)
(II‑233)
где Φ – постоянная Фарадея (Кл·моль-1), а ГH, ГOH и ГM,i – поверхностные избыточные концентрации H+ и OH- и других комплексных образований, соответственно, zi – величины зарядов комплексных образований с соответствующими им знаком.

| Рисунок II-35. Зависимости адсорбции металлов на SiO2 от величины pH водного раствора. (White W.M., 1997). pH-dependent sorption of metal cations on iron hydroxide (after Drever 1997) Зависимость адсорбции катионов металлов на гидроокиси железа от величины pH |
Таким образом, плотность поверхностного заряда минерала определяется уравнением:
 . (II‑234)
. (II‑234)
В этом уравнении первое слагаемое характеризует постоянный поверхностный заряд, который не зависит от состава раствора, а второе слагаемое является результатом адсорбции и зависит от присутсвия и состава воды, прежде всего от величины pH. В кислых растворах на поверхности преобладают протоны и обеспечивают повсеместно положительный заряд поверхности. При высоких pH атомы поверхность минерала становится депротонированной и повсеместно заряженной отрицательно. Очевидно, что существует величина pH, при которой сумма положительных зарядов становится равной сумме отрицательных, и общий заряд поверхности равен 0. Эту величину pH называют точкой нулевого заряда (point of zero charge - PZC), pHPZC.

| Fig, 13 Cation and anion exchange behavior of minerals as a function of pH "negative" and "positive"' relates to the charge of the surfaces, so that "negatives" are cation exchanger and "positives" anion exchanger. Поведение обмена катионов и анионов минерала как функция pH (after Bohn et al. 1979); «отрицательные» и «положительные» Связываются сзарядом поверхности так, что |
Величина pHPZC играет важную роль в оценке адсорбционных свойств минерала. Её определяют в дистиллированной воде, когда σi = 0, и поверхностный заряда зависит только от величины pH. Величина pHPZC, при которой поверхности минерала становится нейтральной, т.е. с зарядом 0, определяется как нулевая точка только протонного заряда (zero point of net proton charge, ZPNPC). Чаще её называют просто изоэлектрической точкой (isoelectric point) и часто обозначают, как pI.
Минерал в дистиллированной воде представляет собой электрод, с которым взаимодействуют только ионы диполя H2O. Величину электрического заряда на этом электоде, согласно уравнению Нернста, равна:
 (II‑235)
(II‑235)
где  – стандартный электродный потенциал поверхности минерала, если активность H+ aH равна 1, zH – его заряд, R – газовая постоянная, T – абсолютная температура, Φ -число Фарадея. Это уравнение показывает зависимость электрического потенциала поверхности минерала от величины pH. Когда поверхность минерала имеет поверхностный заряд Eпов. равный 0, имеем:
– стандартный электродный потенциал поверхности минерала, если активность H+ aH равна 1, zH – его заряд, R – газовая постоянная, T – абсолютная температура, Φ -число Фарадея. Это уравнение показывает зависимость электрического потенциала поверхности минерала от величины pH. Когда поверхность минерала имеет поверхностный заряд Eпов. равный 0, имеем:
 . (II‑236)
. (II‑236)
При температуре 25oC имеем:
 . (II‑237)
. (II‑237)
Изоэлектрическая точка- величина pH, при которой поверхностный заряд минерала равен 0, вследствие адсорбции и десорбции только протонов H+. и определяют по значению pH, при котором суспензия взвешенных частиц данного минерала имеет самую низкую подвижность в электрическом поле. Изоэлектрическая точка в отличие от точки нулевого заряда не зависит от минерального состава воды и является характеристикой свойств минералов.
Рисунок II-36. Примеры изоэлектрических точек(pI) для разных минералов
| Минерал | pI | Источник |
| Кварц α-SiO2 | 2-3,5 1,7-3,5 | Murray, J.P., Parks G.A.1980; Kosmulski M., 2001 |
| SiO2 гель | 1,0-2,5 | Drever J. I. , 1988 |
| Альбит NaAlSi3O8 | 2,0 | Murray, J.P., Parks G.A.1980 |
| Каолинит Al(Si4O10)(OH)8 | 2-4,6 | Murray, J.P., Parks G.A.1980 |
| Монтмориллонит | ≤2,5 | Murray, J.P., Parks G.A.1980 |
| Гематит Fe2O3 | 5-9 8,4-8,5 | Drever J. I. , 1988 Kosmulski M., 2001 |
| Окись гамма-железа (III) (маггемит) Fe2O3 | 3,3-6,7 | Kosmulski M., 2001 |
| Магнетит Fe3O4 | 6,5 6,5-6,8 | Drever J. I. , 1988 Kosmulski M., 2001 |
| Гётит FeOOH | 6-7 | Drever J. I. , 1988 |
| Fе(ОН)3 | 8,5 | Stumm W., Morgan J.J., 1981 |
| Корунд Al2O3 | 9,1 8-9 | Drever J. I. , 1988 Kosmulski M., 2001 |
| Окись гамма-алюминия (gamma alumina) Al2O3 | 7-8 | Kosmulski M., 2001 |
| Гиббсит Al(OH)3 | ~9 | Drever J. I. , 1988 |
| Boehmite (gamma AlOOH) | 7,2-8,2 | Kosmulski M., 2001 |
| Пиролюзит, δ-МnО2 | 2,2 | Davis J. A., Kent D. B., 1990 |
| Рутил, TiO2 | 5,8 | Davis J. A., Kent D. B., 1990 |
Каждый минерал или взвешенная микрочастица имеют свое характерное значение pI. Например, кварц имеет pI около 2,0, каолинит - 3,5, гиббсит (Al(OH)3) – 9, кальцит (CaCO3) - 9,5. Дж.А. Паркс (1967) показал, что группа ≡Al−OH на поверхности алюмосиликатов имеет pI 6,8 или 9,2, а группа ≡Si−OH – 1,8. Поэтому алюмосиликаты с преобладанием кремниевых тетраэдрических слоев, в частности слюды, гидрослюды и монтмориллониты, имеют низкие значения pI. Напротив, каолиниты с низкими отношениями SiO2 /Al2O3, обладают значительно более высокими значениями pI, и в наибольшей степени подвержены влиянию pH.
По величине pI можно приблизительно оценить величину поверхностного заряда. Если в уравнение II-230 величину  выразить через pI с помощью уравнения II-231, то получим:
выразить через pI с помощью уравнения II-231, то получим:
 (II‑238)
(II‑238)
При температуре около 25oC это уравнение имеет вид:
 . (II‑239)
. (II‑239)
Если pH воды ниже значения pI поверхность минерала заряжена положительно и служит адсорбентом анионов, если выше pI – поверхность заряжена отрицательно и адсорбирует катионы. Так как pH подземных вод обычно не выходит за пределы 6,5 – 8,5, а большинство породообразующих минералов имеет pI ниже этого интервала, в геологической среде преобладает катионный обмен. Минералы с величинами pI близкими к 7 способны менять свои адсорбционные предпочтения. Например, гидроокислы железа с pI 6-7 в зонах окисления сульфидных месторождений, при низких pH, активно адсорбируют анионы 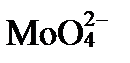 ,
,  ,
,  ,
,  ,
, 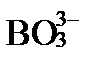 и др. Но при увеличении значения pH выше 7 вызывает десорбцию этих же анионов.
и др. Но при увеличении значения pH выше 7 вызывает десорбцию этих же анионов.
Однако в природных условиях величина точки нулевого заряда зависит от состава подземной воды, вследствие образования минеральных комплексов при хемосорбции.
Часть заряда на внутренней поверхности слоя Гельмгольца компенсируется компонентами в составе воды.
Диффузный слой Гуи
Между внешним слоем Гельмгольца и плоскостью скольжения располагается слой, называемый диффузионным слоем Гуи (Gouy diffusion layer). В этом слое растворенные компоненты не связаны с минералом и двигаются, подчиняясь законам и диффузии, и электростатики. Распределение ионов в этом слое определяется электростатическим полем, которое создается зарядом на внешней границе слоя Гельмгольца.
Заряды внешней границы слоя Гельмгольца σδ и заряд диффузного слоя в целом равны по величине, но противоположны по знаку. Поэтому вся система адсорбции электрически нейтральна. Заряд диффузного слоя распределен в его объеме, образуя электростатическое поле. В условиях низких потенциалов можно допустить, что поверхностный заряд слоя Гельмгольца σδ и его потенциал φδ. связаны уравнением:
 (II‑240)
(II‑240)
где I –ионная сила раствора, моль·м-3, ε0 – электрическая постоянная, равная 8,85·10-12 Кл·В-1м-1, εr –относительная электрическая проницаемостьрастворителя,а κ – длина Дебая (Debye length)с размерностью м-1.
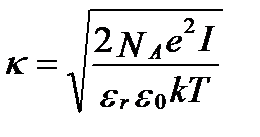 . (II‑241)
. (II‑241)
где k- постоянная Больцмана, равная 1,38·10-23 Дж·К-1, NA – число Авогадро, равное 6,02·1023 моль-1, e – элементарный заряд, равный 1.60·10−19 Кл, T – абсолютная температура. При температуре 25oC имеем:
 , (II‑242)
, (II‑242)
где ионная сила I выражена в молях/л. Тогда элекрический потенциал на расстоянии x от этой поверхности можно приблизительно оценить по уравнению:
 (II‑243)
(II‑243)
где φx – электрический потенциал на расстоянии x от поверхности слоя Гельмгольца, φ0 – потенциал на поверхности слоя Гельмгольца. Здесь величина длины Дебая характеризует расстояние на котором потенциал уменьшается в 2,72 раз. Благодаря диссоциации H2O длина Дебая не может быть более 680 нм. В дистиллированной воде, вследствие загрязнения, её величина не превышает несольких сотен нанометров. С ростом минерализации величина длины Дебая уменьшается.

| Рисунок II-37. Строение двойного электрического слоя на границе минерала и воды. (I - плоскость Гельмгольца, II - плоскость скольжения, δ - слой Гельмгольца (Штерна), λ - слой Гуи, ζ - слой Нернста, φζ - потенциал электрокинетический, φ0 - потенциал поверхностный, φδ - потенциал диффузного слоя). |
В целом потенциал электрического поля в диффузном поле уменьшается экспоненциально и на очень большом удалении равен 0. Поэтому толщина самого диффузного слоя для хорошо перемешиваемых растворов находится в интервале 0,01 - 0,001 мм. В проточных микропорах и трещинах её внешнеё границей часто служит плоскость скольжения. Тогда диффузный слой Гуи делится на подвижную часть, которая перемешивается вместе с гравитационными водами, и неподвижную часть, которую часто называют диффузным слоем Нернста (Nernst diffuse layer), а ее толщину эффективной толщиной диффузного слоя (effective diffuse layer thickness). На внешней границе слоя Нернста сохраняется некоторый электрический потенциал, который называют электрокинетическим (electrokinetic) или зета-потенциалом (Zeta-potential)(Рис. II-19).
Электрокинетический потенциал является функцией поверхностного потенциала, адсорбированных молекул на поверхности раздела, а также природы и состава подземных вод. Именно электрокинетический потенциал служит характеристикой заряда двойного слоя. Для взвешенных частиц его величина близка к 25 мВ, при максимуме 100 мВ. pH, при которой зета-потенциал равен 0, называется изо-электрической точкой.
По мере падения потенциала электрического поля концентрации противоположно заряженных ионов падают, а одинаково заряженных растут и раствор постепенно приобретает состав свойственный подвижной подземной воде (Рис. II-20).

| Рисунок II-38. Распределение катионов и анионов у отрицательно заряженной поверхности при 3 уровнях концентрации в гравитационной воде (из Fetter C.W., 1992). |
Адсорбция играет важную роль в формировании состава подземных вод. Она способствует соосаждению некторых ионов в процессе минералообразования. Согласно правилу Фаянса-Панета (Fajans-Paneth rule)адсорбционно соосаждаются те ионы, которые образуют с противоположно заряженным ионом осаждающегося минерала малорастворимую соль. При этом, чем ниже растворимость этой соли, тем активней идет соосаждение. По этой причине, например, вместе с образованием кальцита хорошо соосаждаются Zn2+, Pb2+ (их карбонаты малорастворимы) и 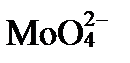 ,
,  ,
,  (их соединения с Ca2+ плохо растворимы).
(их соединения с Ca2+ плохо растворимы).
В очень узких капиллярах диффузионные слои Гуи противоположных стенок перекрывают друг друга. Вследствие этого вода в капиллярах становится заряженной вследствие избытка ионов одного знака (рис. II-21). Это мешает миграции ионов с тем же знаком заряда, что и у слоя Гельмгольца. В связи с этим возникает химическое фракционирование. Такая способность тонкодисперсных грунтов пропускать через себя растворитель, и избирательно пропускать растворенные вещества называется мембранным или осмотическим эффектом (membrane effect, effect of osmosis). Глинистые грунты вследствие этого могут играть роль полупроницаемлй мембраны.

| Рисунок II-39. Концентрации катионов С+ и анионов С- в диффузном двойном слое отдельной частицы (а) и в поровом пространстве капилляра (б). Показано, как анионы исключаются из узких пор. |
Но главная роль адсорбции заключается в том, что она является важным и неизбежным посредником во взаимодействии подземных вод и пород, который создает условия для масообмена между ними. На внешней границе двойного диффузного слоя, между диффузным слоем и подвижной водой, идет активный обмен ионами. Направленность этого обмена легко меняется в зависимости от гидрохимической обстановки, и активно влияет на распределение микрокомпонентов в составе подземных вод. Этот процесс называют ионным обменом (ion exchange). На внутренней стороне двойного диффугного слоя, в слое Гельмгольца и на поверхности минералов идут химические процессы, вследствие которых образуются или разрушаются поверхностные комплексы. Конечным результатом этих процессов является растворение минералов (solution of mineral)или минералообразование (mineral generation).
Ионный обмен
Ионным обменом (ion exchange) формально называют обратимый процесс обмена между адсорбированными и свободными ионами в растворе. В нем участвуют ионы одного знака в количествах пропорциональных заряду. Адсорбенты в таких случаях иногда называют ионообменниками (exchangers)или ионитами (ion exchangers), а ионы, участвующие в нём, - адсорбатами.
Механизм этого процесса однозначно не определен. Почвоведы и гидрогеологи, которые имею дело с подвижными гравитационными водами, полагают, что в этом процессе участвуют преимущественно ионы диффузного слоя и, в крайнем случае, внешнесферных поверхностных комплексов. Минералоги и физхимики допускают к участию компоненты внутрисферных комплексов или даже структур самих кристаллов (в случае глинистых минералов). Поэтому существующие уравнения ионного обмена имеют преимущественно эмпирический характер и рассматривают его, по существу, как процесс массообмена через плоскость скольжения.
Обменная ёмкость
Можно полагать, что в ионном обмене участвуют не все адсорбированные ионы, а только наименее прочно удерживаемые электростатическими силами. Характер и объем этих ионов определяются свойствами взаимодействующих сред и в стабильных условиях остаются постоянным.
Характер этих ионов определяется величиной изоэлектрической точки pI. Если pI минерала больше pH раствора в ионном обмене участвуют только анионы, если меньше pH – в обмене участвуют только катионы. Так как pH подземных вод обычно не выходит за пределы 6,5 – 8,5, а большинство породообразующих минералов имеет pI ниже этого интервала, в геологической среде преобладает катионный обмен. Минералы с величинами pI близкими к 7 способны менять свои адсорбционные предпочтения. Например, гидроокислы железа с pI 6-7 в зонах окисления сульфидных месторождений, в кислых водах (низкие pH), активно адсорбируют анионы 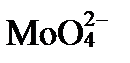 ,
,  ,
,  ,
,  ,
, 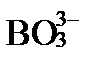 и др. Но в щелочных водах (pH больше 7) вызывают десорбцию этих же анионов.
и др. Но в щелочных водах (pH больше 7) вызывают десорбцию этих же анионов.
Все участвующие в обмене ионы располагаются у поверхности минерала, и их количество определяется удельной поверхностью и плотностью заряда. Общий электрический заряд этих ионов, называют обменной емкостью (exchange capacity, EC).
Эта обменная ёмкость измеряется в эквивалентах заряда, а именно в мг-экв/100 г (meq/100g), в условиях равновесия при pH равном 7. Если адсорбируются катионы, этот параметр называют катионной обменной емкостью(cation exchange capacity -CEC), если анионы – анионной обменной емкостью (anion exchange capacity -AEC). Обменная емкость в мг-экв на килогграмм породы будет в 10 раз больше. В гидрохимии иногда пользуются величиной обменной ёмкости, отнесенной не к массе породы, а к единице объёма поровой воды. Тогда обменная емкость характеризуется количеством ионов, поглощаемых породой из 1 л порового раствора. Пересчет от одной формы выражения обменной емкости к другой осуществляется, согласно уравнению (II-222), имеет вид:
 , (II‑244)
, (II‑244)
где  - обменная ёмкость воды в мг-экв·л-1 подземной воды, EC - обменная емкость породы в мг-экв на 100 г породы, Vw - концентрация воды в породе, e - приведенная пористость, r - плотность скелета породы.
- обменная ёмкость воды в мг-экв·л-1 подземной воды, EC - обменная емкость породы в мг-экв на 100 г породы, Vw - концентрация воды в породе, e - приведенная пористость, r - плотность скелета породы.
Существует много методов определения обменной ёмкости. Обычно её измеряют по уменьшению концентрации катионов Na+,Ca2+, Br2+ или NH4+ (в почвоведении) в растворе на каждые 100 г сухого грунта. При определении обменной емкости необходимо учитывать состав адсорбента. В частности ацетат аммония способен взаимодействовать с кальцитом, образуя ионы Ca2+. В зависимости от метода определения обменная емкость может быть статической и динамической. Среди динамических обменных ёмкостей различают рабочую и полную.
Статической (равновесной) обменнойемкостью (static exchange capacity)считается та, которая получена в стабильных условиях, когда адсорбент помещют в воду, встряхивают и выдерживают для достижения равновесия и надежных результатов (до 24 часов). Эта обменная емкость определяется по формуле:
 , (II‑245)
, (II‑245)
где ΔCэ,i – изменение концентрации компонента i в растворе, V – объем раствора, gсорб. - вес адсорбента.
Динамическая обменная емкость (dynamic exchange capacity)определяется при фильтрации раствора через колонку адсорбента по выходным кривым, т.е. по характеру изменения концентрации адсорбата в воде на выходе из колонки. Рабочая динамическая обменная емкость (working dynamic exchange capacity)определяется по объему раствора, прошедшего через колонку адсорбента к моменту появления адсорбата на выходе:
 , (II‑246)
, (II‑246)
где Cэ,i - исходная концентрация адсорбата на входе в колонку, Vпр. – объем раствора, пропущенный через колонку до момента появления адсорбата на выходе, gсорб. – вес адсорбента в колонке.
Полная динамическая обменная емкость (total dynamic exchange capacity)определяется по обмъему раствора и изменению концентраций адсобатов до возвращения раствора к исходному составу. В этом случае фильтрация раствора с адсорбатом через колонку адсорбента сопровождается контролем изменения состава раствора на выходе до момента его стабилизации. Это означает, что адсорбент насыщен полностью и не поглощает ионы из раствора. Полная динамическая обменная емкость определяется по формуле:
 , (II‑247)
, (II‑247)
где V- общий объем раствора, пропущенный через колонку адсорбента, Cэ,i – исходная концентрация адсорбата в растворе, Vn и Cэ,i,n – объемы отдельных порций раствора на выходе и средние концентрации адсорбата i в них. Более подробные сведения о методах определения обменной емкости можно найти в ГОСТ'ах 20255.1-89 и 20255.2-89.
Пример II‑9:
После помещения в литр раствора 300 г сухого кварцевого песка, концентрация сорбата в воде уменьшилось на 3 мг-экв/л. Определить статическую обменную емкость поровой воды, если пористость песка n = 0,2, а его плотность ρ = 2,65 г/см3.
Согласно эксперименту EC равна 0,01×3/300=1 мг-экв·100 г-1. Тогда, согласно уравнениям (II-240) и размерностям исходных данных

 .
.
Приведенная пористость определяется по уравнению
 .
.
Отсюда e равняется соответственно 0,25, а Gr - 2,65/0,25=10,6 г/см3. Тогда при пористости 0,2 имеем CECw =10,6∙1∙10 =106 мг-экв·л-1. Эта величина вполне сопоставима с содержанием минеральных компонентов в подземных водах. Пресные воды обычно содержат не более 10 мг-экв/л катионов.
Величина обменной емкости служит важной характеристикой свойств пород, осадков и, особенно, почв (Табл. II-19). Она, как правило, увеличивается с ростом дисперсности, а также содержания глин и органического вещества, так как именно они являются наиболее ёмкими адсорбентами.
| Рисунок II-40. Основные кристаллические структуры глинистых минералов. | 
|
Обменные свойства глин связаны с особенностями их слоистой кристаллической структуры. Их слои имеют два основных типа структуры: октаэдрический и тетраэдричсекий (Рис. II-23). Первый состоит из катионов (обычно Al+3, реже Mg и Fe), окруженных шестью анионами O-2 или OH-. Второй имеет общий состав n×Si4O10 и состоит из кремнекислородных тетраэдров  , связанных между собой общим атомом кислорода. Разнообразие составов и свойств глинистых минералов определяется соотношением этих слоев в пакетах, степенью замещённости Si на Al и составом внедренных катионов. В промежутках между двухэтажными и трехэтажными пакетами могут располагаться молекулы H2O или даже органические соединения. В наиболее простых минералах типа каолинита (kaolin)на один октаэдрический слой приходится один тетраэдрический. Идеальная формула каолинита Al2Si2O5(OH)4. Эти двухслойные пакеты прочно связаны, не набухают и обладают низкой EC. Более рыхлые гидрослюды (illites)и монтмориллониты (montmorillonite)имеют на один октаэдрический слой два обращенных к нему тетраэдрических. Но гидрослюды более плотные и практически не набухают и не поглащают воду. Монтмориллониты имеют формулу Al2Si4O16(OH)2×nH2O и слабо связанные пакеты, между которыми проникает H2O. Поэтому они легко впитывают воду, набухают и обладают очень высокой EC. В двухслойных каолинитовых постройках отношение SiO2 /Al2O3 варьирует от 2,0 до 2,2, а в трехслойных достигает 4,0. Такая рыхлая слоистая структура глинистых минералов определяет их специфические свойства: пластичность, набухаемость и высокую обменную емкость.
, связанных между собой общим атомом кислорода. Разнообразие составов и свойств глинистых минералов определяется соотношением этих слоев в пакетах, степенью замещённости Si на Al и составом внедренных катионов. В промежутках между двухэтажными и трехэтажными пакетами могут располагаться молекулы H2O или даже органические соединения. В наиболее простых минералах типа каолинита (kaolin)на один октаэдрический слой приходится один тетраэдрический. Идеальная формула каолинита Al2Si2O5(OH)4. Эти двухслойные пакеты прочно связаны, не набухают и обладают низкой EC. Более рыхлые гидрослюды (illites)и монтмориллониты (montmorillonite)имеют на один октаэдрический слой два обращенных к нему тетраэдрических. Но гидрослюды более плотные и практически не набухают и не поглащают воду. Монтмориллониты имеют формулу Al2Si4O16(OH)2×nH2O и слабо связанные пакеты, между которыми проникает H2O. Поэтому они легко впитывают воду, набухают и обладают очень высокой EC. В двухслойных каолинитовых постройках отношение SiO2 /Al2O3 варьирует от 2,0 до 2,2, а в трехслойных достигает 4,0. Такая рыхлая слоистая структура глинистых минералов определяет их специфические свойства: пластичность, набухаемость и высокую обменную емкость.
Поверхностные активные центры глин связаны с многочисленными нарушениями целостности их кристалличекой решетки и с замещением Si и Al элементами другой валентности. По величине обменной емкости глинистые минералыделят на три группы:
1) малая емкость (<15 мг-экв·100 г-1): глинистые минералы каолинитовой группы;
2) средняя емкость (15-80 мг-экв·100 г-1): гидрослюды, иллит и др.;
3) большая емкость (>80 мг-экв·100 г-1): глинистые минералы монтморилонитовой группы (монтмориллонит, нонтронит, бейделлит, сапонит, соконит), вермикулит и бентонит;
Очень высокой (до 400 мг-экв·100 г-1) обменной ёмкостью так же обладает многие органические вещества. В целом наименьшей обменной ёмкостью обладают породы, особенно плотные с низкой пористостью. Значительно больше её величина у рыхлых осадков и почв. Обычно обменная емкость почв меняется от < 3 мгэкв/100г в песчаных почвах до >25 мг-экв/100 г в почвах с высоким содержание глин или органического вещества. Обменная емкость почв зависит от содержания глинистых минералов, органического вещества, окислов или гидроокислов. Величину их обменной емкости можно грубо оценить по эмпирической формуле:
EC = 0,7×G+3,5×Cорг, (II‑248)
где G - весовое содержание глинистых частиц (%) размером менее 2 мкм, Cорг - весовое содержание органического углерода (%).
Наконец, обменная емкость минералов зависит от величины pH окружающей воды. С уменьшением pH катионная обменная емкость уменьшается, а анионная увеличивается. Поэтому в кислых водах катионная обменная ёмкость миниальная. В большинстве случаев величина pH достаточно высока, и анионный обмен играет второстепенную роль.
Рисунок II-41. Адсорбционные свойства глинистых минералов ( Appelo C. A. J., Postma D., 1994)
| Адсорбенты | Обменная емкость, мгэкв/100 г | Обменная емкость, мгэкв/100 г |
| Породы | 2—11 | |
| Пески (светло окрашенные) | 3-5 | |
| Пески (темно окрашенные) | 10-20 | |
| суглинки | 10-15 | |
| Илистые суглинки | 15-25 | |
| Глины и глинистые суглинки | 20-50 | |
| Богатые органикой почвы | 50-100 | |
| Каолиниты | 3-15 | |
| Галлуазит | 5-10 | |
| Глауканит | 5-40 | |
| Хлориты | 10-40 | |
| Иллиты (гидрослюды) | 20-50 | |
| Аллофан | до 100 | |
| Гетит и гематит | до 100 | |
| Монтморилониты | 80-120 | |
| Вермикулиты | 100-200 | |
| Органическое вещество при pH=8 | 150-400 |
|
из
5.00
|
Обсуждение в статье: Слой Гильмгольца и поверхностный заряд |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

