 |
Главная |
Сравнительная характеристика кислородосодержащих кислот галогенов
|
из
5.00
|
HClO HBrO HIO
 уменьшается сила кислоты H – О – I
уменьшается сила кислоты H – О – I
уменьшаются окислительные свойства
увеличиваются восстановительные свойства
Сила кислоты зависит от константы диссоциации, чем она больше, тем сильнее кислота. Чем больше радиус, тем связь слабее, так между O и I связь слабее и становится сильнее между Н и О ═► сила кислот уменьшается →.
Чем меньше радиус и больше электроотрицательность, тем легче принимать электроны ═► окислительные свойства уменьшаются →.
HClO3 HBrO3 HIO3 
 уменьшается сила кислоты
уменьшается сила кислоты
уменьшаются окислительные свойства
увеличиваются восстановительные свойства
При увеличении радиуса галогена связь между О и Г становится слабее, и водород при тянут сильнее ═► сила кислот уменьшается →.
Могут быть и окислителями и восстановителями (кроме HClO3 сильный окислитель)
 HClO4 HBrO4 H5IO6
HClO4 HBrO4 H5IO6
уменьшается сила кислоты
уменьшаются окислительные свойства
Высшая степень окисления у галогенов, они могут быть только окислителями, т.е. только принимать электроны.
Элементы главной подгруппы VI группы. Халькогены.
O S Se Te Po
Общая характеристика
Электронная конфигурация ns2np4
Характерные степени окисления: -2; 0; +2; +4; +6. Наиболее устойчивы максимальная и минимальная.
Кислород
Свойства 8О.
Кислородосодержащие вещества рассматриваются при изложении химии каждого элемента. Поэтому, рассмотрим только его соединения с водородом – Н2О и Н2О2 (в первом О-2, во втором О-).
Кислород в природе имеет три устойчивых изотопа: 16О, 17О и 18О. В свободном состоянии находится в виде двух аллотропных модификаций — кислород О2 и озон О3.
Как известно, аллотропия — способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся лишь числом атомов в молекуле либо строением.
Кислород относят к первой категории аллотропных элементов.
Физические свойства.Кислород в нормальных условиях — газ без цвета и запаха. Вместе с азотом и незначительным количеством других газов свободный кислород образует атмосферу Земли — воздух (23,15% по массе, или 20,95% по объему).
Химические свойства. По реакционной способности уступает только галогенам. Важнейшее химическое свойство кислорода — способность образовывать оксиды почти со всеми элементами. Кислород образует соединения со всеми элементами, кроме некоторых благородных газов (гелия, неона, аргона). С большинством металлов кислород реагирует уже при комнатной температуре:

С неметаллами кислород реагирует, как правило, при нагревании. С фосфором кислород активно реагирует
при температуре 60°С:
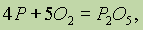
с серой — при температуре около 250°С:

с углеродом (в виде графита) — при 700—800°С:

Взаимодействие кислорода с азотом начинается лишь при 1200 °С или в электрическом разряде:

Кислород реагирует и со многими сложными соединениями, например с оксидами азота (II) он реагирует уже при комнатной температуре:

Сероводород, реагируя с кислородом при нагревании, дает серу:

или оксид серы (IV):

в зависимости от соотношения между кислородом и сероводородом.
В приведенных реакциях кислород является окислителем. В большинстве реакций окисления с участием кислорода выделяется тепло и свет — такие процессы называются горением.
|
из
5.00
|
Обсуждение в статье: Сравнительная характеристика кислородосодержащих кислот галогенов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

