 |
Главная |
Лекция 3. Квантовая теория Бора. Принцип соответствия
|
из
5.00
|
Постулаты квантовой теории Бора (1913):
1) атом может существовать только в определенных стационарных состояниях, которые характеризуются дискретным набором значений энергии  . В этих состояниях атом не излучает и не поглощает энергию;
. В этих состояниях атом не излучает и не поглощает энергию;
2) излучение или поглощение электромагнитной энергии (фотона) происходит при скачкообразном переходе атома из одного состояния  в другое -
в другое -  . Энергия испускаемого или поглощаемого фотона определяется формулой
. Энергия испускаемого или поглощаемого фотона определяется формулой
 , (1.13)
, (1.13)
где  эрг.с – постоянная Планка.
эрг.с – постоянная Планка.
Первый постулат - факт существования стабильного атома. Второй постулат связан с комбинационным принципом:
 . (1.14)
. (1.14)
Отсюда:
 . (1.15)
. (1.15)
Значения  определяют уровни энергииатома. Совокупность этих значений - энергетический спектр. Согласно формуле (1.11) энергетический спектр атома водорода:
определяют уровни энергииатома. Совокупность этих значений - энергетический спектр. Согласно формуле (1.11) энергетический спектр атома водорода:
 . (1.16)
. (1.16)
Число n=1, 2, 3,..., - главное квантовое число (Бор, 1913). Отрицательный знак энергии: электрон в атоме находится в связанном состоянии (финитное движение).
Наименьшее значение энергии (наибольшая величина энергии связи) электрона в атоме водорода (  ) - основное, или нормальное состояние. При
) - основное, или нормальное состояние. При  энергия
энергия  (состояние покоя электрона на бесконечности). Схема уровней энергии атома водорода (рис.1.5). Состояния при
(состояние покоя электрона на бесконечности). Схема уровней энергии атома водорода (рис.1.5). Состояния при 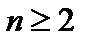 - возбужденныесостояния атома. Величина
- возбужденныесостояния атома. Величина  - потенциал (В), или энергия ионизации(эВ).
- потенциал (В), или энергия ионизации(эВ).
В возбужденных состояниях атом может находиться в течение времени  с, затем переходит в основное состояние. Вместе с тем, существуют возбужденные состояния, в которых атом находится длительное время – порядка
с, затем переходит в основное состояние. Вместе с тем, существуют возбужденные состояния, в которых атом находится длительное время – порядка  с и больше. Это – метастабильные состояния.
с и больше. Это – метастабильные состояния.
Объяснение спектральных серий атома водорода.

Для атома водорода и водородоподобных атомов условие квантованиякруговых орбит:
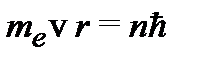 , (1.17)
, (1.17)
где 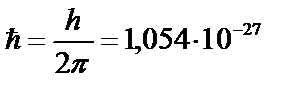
 – «перечеркнутая» постоянная Планка (ввел Дирак); число n = 1,2,3,.... При обращении электрона по круговой орбите вокруг ядра:
– «перечеркнутая» постоянная Планка (ввел Дирак); число n = 1,2,3,.... При обращении электрона по круговой орбите вокруг ядра:
 , (1.18)
, (1.18)
где  – заряд ядра атома. Учитывая
– заряд ядра атома. Учитывая  r, где
r, где 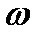 – угловая скорость вращения электрона вокруг ядра, из (1.18) получим соотношение, известное в механике как третий закон Кеплера(1619):
– угловая скорость вращения электрона вокруг ядра, из (1.18) получим соотношение, известное в механике как третий закон Кеплера(1619):
 . (1.19)
. (1.19)
Условие квантования (1.17):

 . (1.20)
. (1.20)
Исключая частоту из (1.19), (1.20)
 . (1.21)
. (1.21)
Радиус окружности электрона в атоме имеет дискретный набор значений, т.е. орбиты являются квантованными. Боровские орбиты.
 . (1.22)
. (1.22)
Квантование энергии. Полная энергия электрона
 . (1.23)
. (1.23)
 . (1.24)
. (1.24)
Согласно Бору волновые числа спектральных линий водородоподобных атомов:
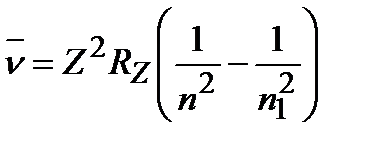 , (1.29)
, (1.29)
постоянная Ридберга
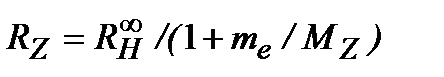 . (1.29a)
. (1.29a)
Зависимость постоянной Ридберга от массы ядра приводит к изотопическому смещениюспектральных линий. Открытие тяжелого изотопа водорода – дейтерия(Юри,1932).
Принцип соответствия(Бор, 1920). При достаточно больших значениях главного квантового числа изменение энергии происходит очень малыми скачками, почти непрерывно. Общая формулировка принципа соответствия: при больших значениях главного квантового числа результаты квантовой теории согласуются и совпадают с результатами классических представлений. Например, по классическим представлениям частота линии излучения атома определяется частотой обращения электрона вокруг ядра. Согласно формулам (1.20), (1.21):
 . (1.30)
. (1.30)
По квантовым представлениям частота линии излучения определяется разностью термов по формуле (1.14). Если числа  большие (
большие (  ), а разность
), а разность  мала, то
мала, то
 . (1.31)
. (1.31)
Если  , то формулы (1.30), (1.31) совпадают. При
, то формулы (1.30), (1.31) совпадают. При  формула (1.31) определяет обертоны классической частоты. В этом - принцип соответствия.
формула (1.31) определяет обертоны классической частоты. В этом - принцип соответствия.
|
из
5.00
|
Обсуждение в статье: Лекция 3. Квантовая теория Бора. Принцип соответствия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

